题目内容
19.常温下,将一定量的氯气通入100mL 4mol/L的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )| A. | 当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA | |
| B. | 当溶液中Na+为0.4 NA时,溶液中的Cl-为0.2 NA | |
| C. | 当电子转移数目为0.2 NA时,溶液质量增加14.2 g | |
| D. | 当溶液质量增加7.1 g时,溶液中ClO-为0.1 NA |
分析 A.Cl2为2.24 L时,状况未知,不能计算其物质的量;
B.100mL 4mol/L的氢氧化钠溶液中,钠离子的物质的量为0.1L×4mol/L=0.4mol,Na+为0.4 NA,且钠离子不参加反应;
C.由Cl2+2NaOH=NaCl+NaClO+H2O可知,电子转移数目为 NA时,只有1mol氯气参加反应,溶液质量增加71g;
D.当溶液质量增加7.1 g时,即参加反应的氯气为$\frac{7.1g}{71g/mol}$=0.1mol.
解答 解:A.Cl2为2.24 L时,状况未知,不能计算其物质的量,则不能计算转移电子,故A错误;
B.100mL 4mol/L的氢氧化钠溶液中,钠离子的物质的量为0.1L×4mol/L=0.4mol,Na+为0.4 NA,且钠离子不参加反应,则不能确定反应进行的程度,无法计算溶液中Cl-的物质的量,故B错误;
C.由Cl2+2NaOH=NaCl+NaClO+H2O可知,电子转移数目为 NA时,只有1mol氯气参加反应,溶液质量增加71g,则当电子转移数目为0.2 NA时,溶液质量增加为0.2mol×71g/mol=14.2 g,故C正确;
D.当溶液质量增加7.1 g时,即参加反应的氯气为$\frac{7.1g}{71g/mol}$=0.1mol,由反应可知,生成NaClO为0.1mol,但ClO-水解,则溶液中ClO-小于0.1 NA,故D错误;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,涉及物质的量的计算、氧化还原反应中转移电子的计算及盐类水解等,侧重分析与计算能力的考查,综合性较强,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
10.硅是一种重要的非金属单质,其化学性质与碳既有相似之处,也有不同之处.在常温下,下列物质能够与硅发生反应的是( )
| A. | HF | B. | HNO3 | C. | NaCl | D. | H2SO4 |
10. 光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
 光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )| A. | 从第10min到第12min时,生成Cl2的速率v(Cl2)=0.01mol•L-1•min-1 | |
| B. | 第8min时与第18min时反应的平衡常数相同 | |
| C. | 由于10min时条件的改变,使COCl2的转化率降低 | |
| D. | 在第14min时,改变的条件可能是压缩反应容器的体积 |
7.紫苏醇的结构简式如图所示.下列有关紫苏醇的说法正确的是( )


| A. | 与乙醇互为同系物 | |
| B. | 一定条件下能与乙酸发生酯化反应 | |
| C. | 存在属于芳香族化合物的同分异构体 | |
| D. | 能与溴水、酸性高锰酸钾溶液发生加成反应 |
14.下列关于物质结构的叙述中正确的是( )
| A. | 分子晶体中一定含有共价键 | |
| B. | 离子晶体中一定含有离子键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有非极性键的分子一定是非极性分子 |
4.下表中对应关系正确的是( )
| A.由淀粉得到的酒精,Na2S溶液中存在的HS- | 均为水解反应生成 |
| B.C+CO2=2CO,3C+SiO2=SiC+2CO | 均为碳单质只作还原剂的氧化还原反应. |
| C.由Fe生成FeCl2或FeCl3,由Na生成Na2O或Na2O2 | 均可通过化合反应实现 |
| D.乙醇使酸性KMnO4溶液褪色,SO2使滴有酚酞的NaOH溶液褪色 | 均发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
11.下列过程中,发生了化学变化的是( )
| A. | 磨豆成浆 | B. | 剪纸成花 | C. | 酿谷成酒 | D. | 雕石成像 |
8. 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl${\;}_{4}^{-}$-3e-=4Cl-+Al |
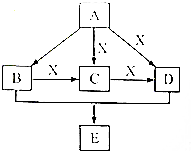 A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题:
A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题: ,工业上大量获得A的方法是石油裂解.
,工业上大量获得A的方法是石油裂解. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;