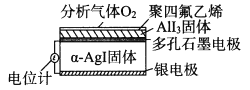
题目内容
【题目】在常温下,向20 mL NaOH溶液中逐滴加入0.1 mol·L-1的醋酸溶液,滴定曲线如下图所示。下列判断中,正确的是

A. 在M点,二者恰好完全反应
B. 滴定前,酸中c(H+)等于碱中c(OH-)
C. NaOH溶液的物质的量浓度为0.1 mol·L-1
D. 在N点,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
【答案】C
【解析】
A、若两者恰好反应,则生成物是CH3COONa,CH3COONa为强碱弱酸盐,水解后溶液的pH>7,而M点的pH=7,说明醋酸过量,故A错误;
B、滴定前c(CH3COOH)=c(NaOH)=0.1 mol·L-1,NaOH是强碱,溶于水完全电离,但CH3COOH为弱酸,溶于水部分电离,所以滴定前,酸中c(H+)小于碱中c(OH-),故B错误;
C、在常温下,根据初始pH=13可知NaOH溶液中氢离子浓度为10-13mol·L-1,则c(NaOH)=0.1 mol·L-1,故C正确;
D、据分析c(NaOH)=0.1 mol·L-1,则N点时,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,此时pH<7,说明CH3COOH的电离大于CH3COONa的水解,但两者程度都很小,所以c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故D错误;
综上所述,本题应选C。

【题目】工业上生产尿素的过程中会生成氨基甲酸铵![]() 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解![]()
实验测得不同温度下容器内的平衡总压强如下表:
温度 |
|
|
|
|
平衡总压强 |
|
|
|
|
![]() 根据上表判断,反应中Q______
根据上表判断,反应中Q______![]() 填写“
填写“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 能说明该反应达到平衡状态的是______
能说明该反应达到平衡状态的是______![]() 填序号
填序号![]() 。
。
![]() 不再变化
不再变化
b.![]()
![]() 混合气体的平均分子质量不再变化
混合气体的平均分子质量不再变化
![]() 混合气体的密度不再变化
混合气体的密度不再变化
![]() 写出该反应平衡常数的表达式
写出该反应平衡常数的表达式![]() ______。
______。![]() 时,反应t分钟后固体的物质的量减少一半,t分钟内用
时,反应t分钟后固体的物质的量减少一半,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ______
______![]() 。
。
氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。![]() 、
、![]() 、
、![]() 都是重要的氮肥。
都是重要的氮肥。
![]() 时,浓度均为
时,浓度均为![]() 的氨水与NaOH溶液,下列说法错误的是______。
的氨水与NaOH溶液,下列说法错误的是______。
![]() 两溶液导电能力不同
两溶液导电能力不同
b.两溶液![]() 不同
不同
![]() 两溶液中水的电离程度不同
两溶液中水的电离程度不同
![]() 两溶液中水的离子积不同
两溶液中水的离子积不同
![]() 同温度、同浓度的
同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 较小的是______溶液,其原因是______。
较小的是______溶液,其原因是______。
![]() 时,向一定量
时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。

【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)