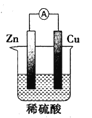
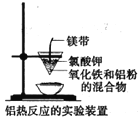
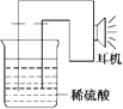
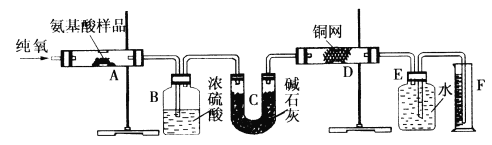
题目内容
【题目】某研究小组以粗盐和碳酸氢铵(![]() )为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为
)为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为![]() ;
;![]() ;
;![]() ;
;![]() 。
。
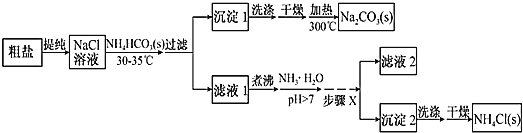
(1)粗盐中主要含有![]() 、
、![]() 、
、![]() 等杂质离子,粗盐提纯时使用的试剂有;①
等杂质离子,粗盐提纯时使用的试剂有;①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() ,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
A.①③④② B.①②④③ C.③②④① D.①②③④
(2)如何运用简单的方法判断粗盐中![]() 是否已除尽?__________。
是否已除尽?__________。
(3)从![]() 溶液到沉淀1的过程中,需蒸发浓缩。在加入固体
溶液到沉淀1的过程中,需蒸发浓缩。在加入固体![]() 之前进行蒸发浓缩优于在加入
之前进行蒸发浓缩优于在加入![]() 之后,原因是___________。
之后,原因是___________。
(4)写出沉淀1受热分解的化学方程式:_________。
(5)为提高![]() 产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
(6)某同学拟通过实验来测定该纯碱的纯度(假设杂质只含有![]() ),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的
),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的![]() 溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中
溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中![]() 的质量分数为____________。(用相关字母表示)
的质量分数为____________。(用相关字母表示)
【答案】B 引流 取少量溶液,滴加![]() 溶液,观察是否有白色沉淀产生
溶液,观察是否有白色沉淀产生 ![]() 的分解温度较低,防止
的分解温度较低,防止![]() 在蒸发浓缩的过程中分解
在蒸发浓缩的过程中分解 ![]() 抑制
抑制![]() 的水解 蒸发浓缩、冷却结晶、过滤
的水解 蒸发浓缩、冷却结晶、过滤 ![]()
【解析】
从流程图中可以看出,粗盐首先提纯为![]() 溶液,向
溶液,向![]() 溶液中加入
溶液中加入![]() 固体并且控制温度不达到
固体并且控制温度不达到![]() 的分解温度,这一步与侯氏制碱法有异曲同工之妙,都是利用溶解度差异使溶解度较低的
的分解温度,这一步与侯氏制碱法有异曲同工之妙,都是利用溶解度差异使溶解度较低的![]() 析出,使复分解反应得以发生,因此沉淀1为
析出,使复分解反应得以发生,因此沉淀1为![]() ,再经过洗涤、干燥、加热分解后即得纯碱,再来看滤液1,滤液1即
,再经过洗涤、干燥、加热分解后即得纯碱,再来看滤液1,滤液1即![]() 溶液,因
溶液,因![]() 会水解,所以向其中加入氨水能抑制其水解,提高产率,再经蒸发浓缩、冷却结晶、过滤即可得到纯的
会水解,所以向其中加入氨水能抑制其水解,提高产率,再经蒸发浓缩、冷却结晶、过滤即可得到纯的![]() 固体,据此来分析各小题即可。
固体,据此来分析各小题即可。
(1)在粗盐提纯时,为了确保杂质除净,各除杂剂要稍微过量,后加入的试剂要能除去先加入的试剂,因此碳酸钠要在氯化钡之后加,盐酸要在碳酸钠和氢氧化钠之后加,过量的盐酸则可通过加热除去,因此答案选B,在过滤时玻璃棒的作用是引流;
(2)相当于在问我们如何检验溶液中是否含有![]() ,因此只需取少量溶液,滴加
,因此只需取少量溶液,滴加![]() 溶液,观察是否产生白色沉淀即可;
溶液,观察是否产生白色沉淀即可;
(3)![]() 的分解温度较低,因此在加入
的分解温度较低,因此在加入![]() 之前蒸发是为了防止
之前蒸发是为了防止![]() 受热分解;
受热分解;
(4)沉淀1即![]() ,
,![]() 受热分解的方程式为
受热分解的方程式为![]() ;
;
(5)![]() 会水解,因此加入氨水可以抑制其水解,提高
会水解,因此加入氨水可以抑制其水解,提高![]() 的产率,步骤X包括的操作有蒸发浓缩、冷却结晶和过滤;
的产率,步骤X包括的操作有蒸发浓缩、冷却结晶和过滤;
(6)m克沉淀即![]() ,代入其分子量可得碳酸钡的物质的量为
,代入其分子量可得碳酸钡的物质的量为![]() ,根据碳元素守恒,因此碳酸钠的物质的量也为
,根据碳元素守恒,因此碳酸钠的物质的量也为![]() ,代入其分子量可得碳酸钠的质量为
,代入其分子量可得碳酸钠的质量为![]() ,因此碳酸钠的质量分数为
,因此碳酸钠的质量分数为![]() ,本题得解。
,本题得解。

【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
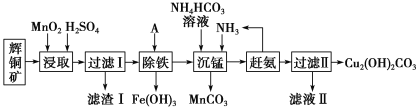
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。