题目内容
【题目】一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH﹣![]() 2CO32﹣+6H2O,则有关说法正确的是 ( )
2CO32﹣+6H2O,则有关说法正确的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
【答案】B
【解析】
试题分析:A、正极上得电子发生还原反应,根据2CH3OH+3O2+4OH﹣![]() 2CO32﹣+6H2O知,放电时,氧气参与反应的电极为正极,甲醇参与的电极是负极,A错误;B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH-﹣6e=CO32﹣+6H2O,B正确;C、标准状况下5.6LO2是5.6L÷22.4L/mol=0.25mol,1分子氧气得到4个电子,则转移电子的物质的量是1mol,C错误;D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为3/2 O2+3H2O+6e-=6OH-,所以通入氧气的电极附近溶液的pH升高,D错误,答案选B。
2CO32﹣+6H2O知,放电时,氧气参与反应的电极为正极,甲醇参与的电极是负极,A错误;B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH-﹣6e=CO32﹣+6H2O,B正确;C、标准状况下5.6LO2是5.6L÷22.4L/mol=0.25mol,1分子氧气得到4个电子,则转移电子的物质的量是1mol,C错误;D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为3/2 O2+3H2O+6e-=6OH-,所以通入氧气的电极附近溶液的pH升高,D错误,答案选B。

【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
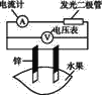
试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑桔 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
请回答以下问题:
(1)实验6中负极的电极反应式为____。
(2)实验1、5中电流方向相反的原因是____。
(3)影响水果电池电压的因素有_____、____。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做____。(填“合理”或“不合理”)