题目内容
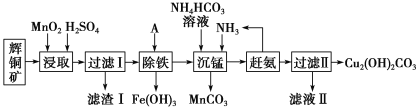
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
【答案】SiO2 2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O 3.7~5.6 4.0×10-11 Mn2++HCO3-+NH3=MnCO3↓+NH4+ (NH4)2SO4
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
(1)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2;
(2) “除铁”主要是除去溶液中Fe3+,根据题干表格可知,若要使Fe3+完全沉淀而不沉淀Cu2+,溶液的pH范围为:3.7~5.6或3.7≤pH<5.6;若溶液pH=5,即c(H+)=1×10-5mol/L,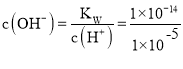 mol/L=1×10-9mol/L,c(Fe3+)=
mol/L=1×10-9mol/L,c(Fe3+)= 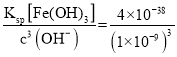 mol/L=4.0×10-11mol/L;
mol/L=4.0×10-11mol/L;
(3)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(4)根据分析,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液,滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体。