题目内容
【题目】下列对实验方案的设计或评价合理的是( )
A. 经酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示具支试管中,一段时间后导管口有气泡冒出
经酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示具支试管中,一段时间后导管口有气泡冒出
B.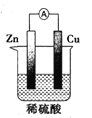 图中电流表会显示电流在较短时间内就会衰减
图中电流表会显示电流在较短时间内就会衰减
C.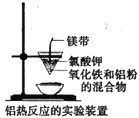 图中应先用燃着的小木条点燃镁带,然后插入混合物中引发反应
图中应先用燃着的小木条点燃镁带,然后插入混合物中引发反应
D.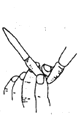 可用图显示的方法除去酸式滴定管尖嘴中的气泡
可用图显示的方法除去酸式滴定管尖嘴中的气泡
【答案】B
【解析】
A. 铁钉遇到饱和食盐水发生吸氧腐蚀,右侧试管中的导管内水柱上升,导管内没有气泡产生,A不合理;
B. 该装置的锌铜电池中,锌直接与稀硫酸相连,原电池效率不高,电流在较短时间内就会衰减,应改为用盐桥相连的装置,效率会更高,B合理;
C. 铝热反应中,铝热剂在最下面,上面铺一层氯酸钾,先把镁条插入混合物中,再点燃镁条用来提供引发反应的热能,C不合理;
D.该图为碱式滴定管,可用图显示的方法除去碱式滴定管尖嘴中的气泡,D不合理;故答案为:B。

练习册系列答案
相关题目