题目内容
【题目】某小组设计如图所示装置,测定工业纯碱(含有少量NaCl)中Na2CO3的含量.
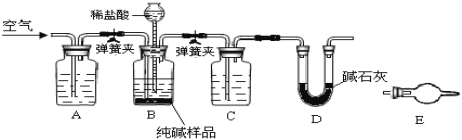
(1)检验装置B气密性:塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气.
(2)装置A的作用是____,装置C中的试剂为___.
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________.
(4)实验前称取28.80g样品,实验后D装置增重8.80g,则样品中Na2CO3质量分数为_____.
【答案】漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降 除去空气中CO2,防止影响测量结果 浓硫酸 必要 因为装置D会吸收空气中的二氧化碳和水蒸气,影响测量结果 73.6%
【解析】
根据装置图和所用试剂,该实验的反应原理为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,通过测量D装置的增重(反应生成的CO2的质量)计算Na2CO3的含量;为了减少实验误差,必须排除空气中CO2和H2O(g)对实验的干扰,以及生成的CO2中混有的H2O(g)对实验的干扰,所以①实验开始前要通入不含CO2的空气赶尽装置中的空气,②反应生成的CO2在被D装置中碱石灰吸收前要干燥,③实验结束必须通入不含CO2的空气将反应生成的CO2全部驱赶到D装置中,④D装置后要连接盛放碱石灰的干燥管,防止外界空气中CO2和H2O(g)对实验的影响;据此分析作答。
(1)根据题意,采用液差法检查装置B的气密性;塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若漏斗中与试剂瓶中的液面差保持不再变化或漏斗中的液面不再下降,说明装置不漏气。
(2)实验通过测量反应生成的CO2的质量计算Na2CO3的含量,为了减少实验误差,装置A中应盛放NaOH溶液,其作用是:除去空气中的CO2,防止影响测量结果(实验开始前用不含CO2的空气赶尽装置中空气,实验结束用不含CO2的空气将反应生成的CO2全部驱赶到D装置中)。装置C中的试剂为浓硫酸,用于除去CO2中的H2O(g)。
(3)由实验目的可知,E中可能装有碱石灰,用于吸收空气中的水和二氧化碳,防止其进入D装置干扰实验。若D装置后不连接E装置,外界空气中的CO2和H2O(g)进入D中,使测得的CO2的质量偏大,引起实验误差,故D装置后有必要连接E装置,理由是:装置D会吸收空气中的二氧化碳和水蒸气,影响测量结果。
(4)D装置增重8.80g,反应生成CO2的质量为8.80g,根据C守恒,n(Na2CO3)=n(CO2)=8.80g÷44g/mol=0.2mol,m(Na2CO3)=0.2mol×106g/mol=21.2g,样品中Na2CO3质量分数为![]() ×100%=73.6%。
×100%=73.6%。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案