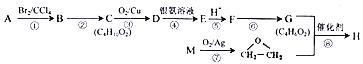
题目内容
【题目】将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。

(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
【答案】1.44g;1.08g;1.4mol/L
【解析】镁铝合金溶解在盐酸中转化为氯化镁、氯化铝,然后加入氢氧化钠溶液,根据图像可知开始阶段没有沉淀产生,说明盐酸过量,沉淀达到最大值后过量的氢氧化钠溶解氢氧化铝,最终的沉淀是氢氧化镁,结合图像分析解答。
(1)由图像可判断10mL溶液中铝离子、镁离子全部沉淀用去氢氧化钠溶液的体积是14mL-2mL=12mL,物质的量是0.012L×1mol/L=0.012mo;而随后氢氧化铝溶解用去了2mL氢氧化钠,物质的量是0.002mol,由Al(OH)3+OH-=AlO2-+2H2O可知生成的氢氧化铝是0.002mol,根据铝原子守恒可知原合金中金属铝的物质的量是0.002mol×200mL/10mL=0.04mol,质量是0.04mol×27g/mol=1.08g;根据Al3++3OH-=Al(OH)3↓可知生成0.002mol氢氧化铝消耗氢氧化钠是0.006mol,则沉淀镁离子消耗氢氧化钠是0.012mol-0.006mol=0.006mol,所以根据Mg2++2OH-=Mg(OH)2↓可知镁离子的物质的量是0.003mol,因此根据镁原子守恒可知原合金中金属镁的物质的量是0.003mol×200mL/10mL=0.06mol,质量是0.06mol×24g/mol=1.44g;
(2)当NaOH滴至14mL时,镁铝全部沉淀,溶液中的溶质全部为NaCl,根据Cl原子守恒,即得n(HCl)=n(NaCl)=n(NaOH)=0.014mol,所以c(HCl)=0.014mol÷0.01L=1.4mol/L。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案