题目内容
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素.
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图 .
(2)写出化合物E2F2的电子式 , 化合物ABC的结构式 .
(3)根据题目要求完成以下填空:
BF32﹣中心原子杂化方式;D3中心原子杂化方式;
FD42﹣微粒中的键角;FD3分子的立体构型 .
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有、(要求写一种分子和一种离子).
【答案】
(1)![]()
(2)![]() ,
,![]()
(3)sp2杂化,sp2杂化,109°28′,平面三角形
(4)N2O、,OCN﹣或SCN﹣或N3﹣
【解析】解:A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,且C能形成单质C2,所以C是N元素;B与D形成的化合物BD与C的单质C2电子总数相等,且C的原子序数大于B小于D,所以B是C元素,D是O元素;CA3分子结构为三角锥形,且A的原子序数小于B,所以A是H元素;D与E可形成E2D与E2D2两种离子化合物,所以E是Na元素;D与F是同族元素,所以F是S元素.
(1)通过以上分析知,D是O元素,原子核外有8个电子,其核外电子排布图为: ![]() .
.
所以答案是: ![]() .
.
(2)化合物E2F2为Na2S2,是离子化合物,和过氧化钠类似,钠离子和S 2﹣之间以离子键结合,硫原子和硫原子之间以共价键结合,所以其电子式 ![]() ;化合物ABC是氢氰酸,结构式为
;化合物ABC是氢氰酸,结构式为 ![]() .
.
所以答案是: ![]() ;
; ![]() .
.
(3)杂化轨道数=σ键个数+孤电子对数,BF32﹣中心原子杂化轨道数=3+0=3,所以采取sp2杂化;D3中心原子杂化轨道数=3,所以采取sp2杂化;
FD42﹣微粒中价层电子对数=4+0=4,所以它的VSEPR模型为正四面体,因为没有孤电子对,所以其空间构型为正四面体,键角是109°28′;FD3分子中价层电子对数=3+0=3,所以它的VSEPR模型为平面三角形,因为没有孤电子对,所以其空间构型为平面三角形.
所以答案是:sp2杂化; sp2杂化; 109°28′;平面三角形.
(4)与BD2互为等电子体且含有C原子的微粒有N2O、OCN﹣或SCN﹣或N3﹣.
所以答案是:N2O;OCN﹣或SCN﹣或N3﹣.

【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
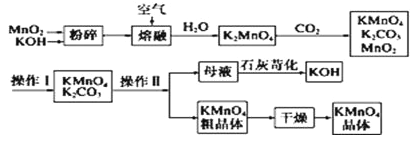
请回答下列问题:
(1)MnO2和KOH在熔融前粉碎的目的是_____________________________________________。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要反应的化学方程式___________。
(3)通入CO2后,生成的KMnO4与MnO2的物质的量之比为___________。
(4)上述流程中可以循环使用的物质有___________、___________(填化学式)。
(5)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___________mol/L。
(6)操作Ⅰ的名称是___________,操作Ⅱ根据下表KMnO4和K2CO3两物质在溶解性上的差异,采用___________、___________(填操作步骤)得到KMnO4粗晶体。
| 10 | 20 | 30 | 40 | 60 |
K2CO3 | 109.0 | 111.0 | 114.0 | 117.0 | 126.0 |
KMnO4 | 4.3 | 6.3 | 9.0 | 12.6 | 22.1 |