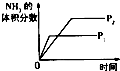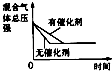题目内容
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图.下列叙述正确的是( )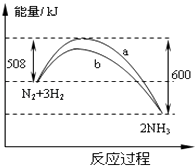
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJ/moL
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率
【答案】B
【解析】A、该反应放出的能量大于吸收的能量,所以放热,书写热化学方程式必须标注物质的聚集状态,该热化学方程式未标注物质的状态,故A不符合题意;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,即可降低生产能耗,故B符合题意;
C、加入催化剂改变反应速率,不改变化学平衡,反应的热效应不变,故C不符合题意;
D、加入催化剂是同等程度的增大或减小正逆反应速率,故D不符合题意;
故答案为:B.
A.热化学方程式书写时必须注明物质的状态;
B.加入催化剂可降低活化能;
C.催化剂不能改变焓变;
D.加入催化剂正逆反应速率同时增大或减小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
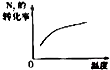
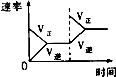
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D