题目内容
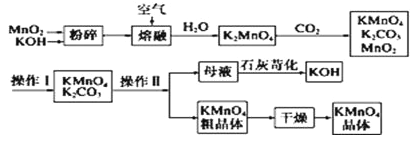
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
请回答下列问题:
(1)MnO2和KOH在熔融前粉碎的目的是_____________________________________________。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要反应的化学方程式___________。
(3)通入CO2后,生成的KMnO4与MnO2的物质的量之比为___________。
(4)上述流程中可以循环使用的物质有___________、___________(填化学式)。
(5)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___________mol/L。
(6)操作Ⅰ的名称是___________,操作Ⅱ根据下表KMnO4和K2CO3两物质在溶解性上的差异,采用___________、___________(填操作步骤)得到KMnO4粗晶体。
| 10 | 20 | 30 | 40 | 60 |
K2CO3 | 109.0 | 111.0 | 114.0 | 117.0 | 126.0 |
KMnO4 | 4.3 | 6.3 | 9.0 | 12.6 | 22.1 |
【答案】 增大反应物与空气的接触面积,加快反应速率 2MnO2+4KOH+O2=2K2MnO4+2H2O 2∶1 KOH MnO2 2.4×10-5 过滤 蒸发浓缩 趁热过滤
【解析】(1)MnO2和KOH在熔融前粉碎的目的是:增大反应物与空气的接触面积,加快反应速率;
(2)MnO2、KOH的熔融混合物中通入空气时,发生反应生成K2MnO4,根据元素守恒可知还应生成H2O,可得MnO2+KOH+O2—K2MnO4+H2O;反应中Mn元素由+4价升为+6价,总升高2价,O元素由0价降为﹣2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,再根据观察法配平其他物质的系数,可得化学方程式2MnO2+4KOH+O2![]() 2K2MnO4+2H2O。
2K2MnO4+2H2O。
(3)向K2MnO4溶液中通入CO2制备KMnO4、K2CO3、MnO2,反应只有Mn元素的化合价发生变化,则该反应为歧化反应,Mn元素由+6价升高到KMnO4中的+7价,共升1价;降低到中的MnO2的+4价,共降2价;则KMnO4与MnO2的物质的量之比为2∶1;
(4)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2以制备KMnO4的步骤中生成的MnO2及最后由母液加入石灰生成的KOH,可以在MnO2、KOH的熔融制备K2MnO4中被循环利用,故答案为:KOH;MnO2;
(5)当pH=10时,c(OH﹣)=1×10-4mol/L,根据Ksp[Mn(OH)2]=c(Mn2+)c2(OH﹣),可知c(Mn2﹣)= 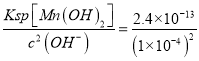 =2.4×10﹣5mol/L,故答案为:2.4×10-5mol/L;
=2.4×10﹣5mol/L,故答案为:2.4×10-5mol/L;
(7)KMnO4、K2CO3易溶于水,而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液;由图可知KMnO4、K2CO3的溶解度随温度变化差异较大,KMnO4的溶解度随温度降低减小较明显,故可以采用蒸发浓缩、趁热过滤的方式得到KMnO4粗晶体。故答案为:过滤;蒸发浓缩;趁热过滤。