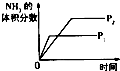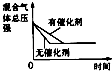题目内容
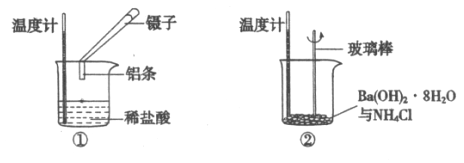
【题目】用如图所示装置(夹持仪器已略去)探究铜与过量浓硫酸的反应。下列实验不合理的是

A. 为确认CuSO4生成,直接向①中加水,观察颜色
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 上下移动①中铜丝可控制SO2的量
【答案】A
【解析】浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成硫酸铜、二氧化硫和水,其反应的方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;二氧化硫具有漂白性,能使品红褪色,当②中品红溶液褪色,说明反应中生成二氧化硫;③中选用NaOH溶液吸收多余的SO2;硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使①中溶液冷却到室温,将①中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色;
CuSO4+SO2↑+2H2O;二氧化硫具有漂白性,能使品红褪色,当②中品红溶液褪色,说明反应中生成二氧化硫;③中选用NaOH溶液吸收多余的SO2;硫酸铜溶于水溶液显蓝色,要检验生成物中有硫酸铜,则熄灭酒精灯并使①中溶液冷却到室温,将①中溶液缓慢地加入到装有水的烧杯中,并不断搅拌,溶液呈蓝色;
A项,反应后溶液呈蓝色,且不能直接向浓硫酸中加水,应取铜与浓硫酸反应后①中溶液,滴入水中,边加边搅拌,溶液显蓝色即可证明有CuSO4生成,故A项错误;
B项,SO2可使品红溶液褪色(化合作用),因此②中品红溶液可以验证SO2的生成,故B项正确;
C项,SO2有毒,能与NaOH溶液反应,因此③中NaOH溶液可以吸收多余的SO2,故C项正确。
D项,上下移动铜丝可以控制铜与浓硫酸的接触面积的大小,从而可以控制反应生成SO2的量,故D项正确;
综上所述,本题正确答案为A。

练习册系列答案
相关题目
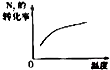
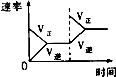
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D