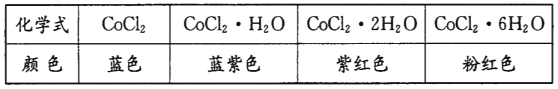
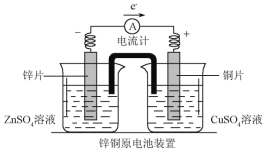
题目内容
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液为实验对象,可探究盐的性质和盐溶液间反应的多样性
实验 | 试剂 | 现象 | 检验 结果 | |
滴管 | 试管 | |||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 | 产物为Ag2SO3 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | 产物含Cu+、Cu2+和SO32 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | 产物为 Al(OH)SO3 | ||
下列说法不正确的是
A. 现象Ⅰ对应的离子方程式:Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. 用稀硫酸证实Ⅱ沉淀中含有Cu+的实验现象是析出红色固体
C. 现象Ⅲ中白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色
D. 上述实验现象涉及了亚硫酸盐的溶解性、氧化还原性及其水溶液的酸碱性
【答案】A
【解析】
A. 0.2mol/LNa2SO3溶液滴入饱和Ag2SO4溶液,发生反应生成白色沉淀Ag2SO3;
B. Cu+与稀硫酸可以发生歧化反应;
C. 根据白色沉淀Al(OH)SO3中所含离子为铝离子、氢氧根离子和亚硫酸根离子分析作答;
D. 根据实验Ⅰ、Ⅱ和Ⅲ现象和反应的原理作答。
A. 实验Ⅰ中0.2mol/LNa2SO3溶液滴入饱和Ag2SO4溶液,相当于稀释了饱和Ag2SO4溶液,因此不可能是Ag2SO4,考虑SO32-的浓度较大,因此推断白色沉淀为Ag2SO3,但并不是沉淀的转化,而是Ag++ SO32- = Ag2SO3↓,故A项错误;
B. 若沉淀中含有Cu+,则加入稀硫酸会发生歧化反应生成铜单质与铜离子,则实验现象会析出红色固体,故B项正确;
C. 白色沉淀Al(OH)SO3中所含离子为铝离子、氢氧根离子和亚硫酸根离子,其中铝离子与强碱反应,氢氧根与强酸反应,亚硫酸根离子具有还原性,可被酸性高锰酸钾氧化,故C项正确;
D. 实验Ⅰ说明Ag2SO3不溶于水,涉及了亚硫酸盐的溶解性;实验ⅡCu2+生成了Cu+,可知发生了氧化还原反应;实验Ⅲ中Na2SO3盐溶液显碱性,与Al2(SO4)3发生复杂的化学变化生成Al(OH)SO3,涉及了水溶液的酸碱性,故D项正确;
答案选A。

【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25