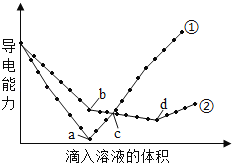
��Ŀ����
����Ŀ��(1)Ǧ���仯������������أ������豸�� X ���߷������ϵȡ��ش��� �����⣺
��Ǧ��̼��ͬ��Ԫ�أ���̼�� 4 �����Ӳ㡣Ǧ��ԭ�ӽṹʾ��ͼΪ_____��Ǧ������������Ӧˮ��������Ա�̼���______(����ǿ����������)��
��PbO2 ��Ũ���Ṳ�����ɻ���ɫ���壬��Ӧ�Ļ�ѧ����ʽΪ_____��
��Ǧ���طŵ�ʱ��������ӦʽΪ_____ ������·���� 2mol ����ת��ʱ�����������缫�����仯�IJ�Ϊ_____g��
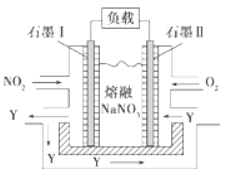
(2)NO2��O2 ������ NaNO3 ������ȼ�ϵ�أ���ԭ������ͼ��ʯī��Ϊ��ص�_____�����õ����ʹ�ù�����ʯī��缫������������ Y����缫��ӦʽΪ_____��
���𰸡� �� PbO2+4HCl��PbCl2+Cl2��+2H2O PbO2+2e�\+4H++SO42�\=PbSO4+2H2O 32 �� 02+2N2O5+4e-��4NO3-
�� PbO2+4HCl��PbCl2+Cl2��+2H2O PbO2+2e�\+4H++SO42�\=PbSO4+2H2O 32 �� 02+2N2O5+4e-��4NO3-
��������
(1)��Ǧ��̼��ͬ��Ԫ�أ���̼�� 4 �����Ӳ㣬��ǦΪ�������ڢ�AԪ�أ�Ǧ��ԭ�ӽṹʾ��ͼΪ ���ǽ�����Խ��������������������Խ������Ǧ������������Ӧˮ��������Ա�̼�������
���ǽ�����Խ��������������������Խ������Ǧ������������Ӧˮ��������Ա�̼�������
��PbO2 ��Ũ���Ṳ�����ɻ���ɫ���壬ͬʱ�����Ȼ�Ǧ��ˮ����Ӧ�Ļ�ѧ����ʽΪPbO2+4HCl��PbCl2+Cl2��+2H2O��
��Ǧ���طŵ�ʱ�������õ�����,������ԭ��Ӧ,�缫��ӦΪ: PbO2 + 2e-+ 4H+ + SO42-=PbSO4 + 2H2O ,����2mol����ת��ʱ,������������303g��239g��64g��Ǧ���طŵ�ʱ�ĸ���ʧȥ����, ����������Ӧ���缫��ӦΪ: Pb- 2e- +SO42-=PbSO4 ,����2mol����ת��ʱ,������������96g ,�����缫�����仯�IJ�Ϊ96g-64g=32g��
(2) NO2��O2������NaNO3������ȼ�ϵ��,ʯīIͨ��NO2 ,ʧȥ����, ����������Ӧ,���Ϊ����,�缫��ӦΪ: NO2-e- + NO3- =N2O5��ʯī��Ϊ����,�õ�����,������ԭ��Ӧ,�缫��ӦΪ: 02+2N2O5+4e-=4NO3-��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������ҺΪʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ�����
ʵ�� | �Լ� | ���� | ���� ��� | |
�ι� | �Թ� | |||
2 mL | 0.2 mol��L1 Na2SO3��Һ | ����Ag2SO4��Һ | ��.������ɫ���� | ����ΪAg2SO3 |
0.2 mol��L1 CuSO4 | ��.��Һ���̣������μӲ����ػ�ɫ���� | ���ﺬCu+��Cu2+��SO32 | ||
0.1 mol��L1 Al2(SO4)3��Һ | ��.��ʼ�����Ա仯�������μӲ�����ɫ���� | ����Ϊ Al(OH)SO3 | ||
����˵������ȷ����
A. ������Ӧ�����ӷ���ʽ��Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. ��ϡ����֤ʵ������к���Cu+��ʵ��������������ɫ����
C. ������а�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ
D. ����ʵ�������漰���������ε��ܽ��ԡ�������ԭ�Լ���ˮ��Һ�������