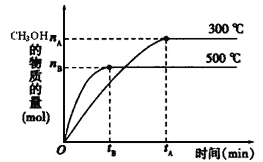
题目内容
【题目】某固体酸燃料电池以![]() 固体为电解质传递
固体为电解质传递![]() ,其基本结构如图,电池总反应可表示为
,其基本结构如图,电池总反应可表示为![]() ,下列有关说法正确的是
,下列有关说法正确的是![]()
![]()
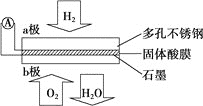
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为![]()
C. 每转移![]() 电子,消耗标准状况下
电子,消耗标准状况下![]()
D. ![]() 由a极通过固体酸电解质传递到b极
由a极通过固体酸电解质传递到b极
【答案】D
【解析】
根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-=2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,标准状况下的体积为1.12L。
A.因氢元素的化合价升高,则a为负极,电子通过外电路由a极流向b,A错误;
B.该电池电解质能传递H+,因此正极b的电极反应式为O2+4e-+4H+=2H2O,B错误;
C.因未指明反应条件是否为标准状况,因此不能确定气体的体积是否为1.12L,C错误;
D.原电池中,a极氢气失电子生成H+,阳离子向负电荷较多的正极移动,所以H+由a极通过固体酸电解质传递到b极,D正确;
故合理选项是D。

【题目】表中关于物质分类的正确组合是( )
组合类别 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | H2O2 | CH3COOH | KOH | CaCl2 |
D | CO2 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A.AB.BC.CD.D
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液为实验对象,可探究盐的性质和盐溶液间反应的多样性
实验 | 试剂 | 现象 | 检验 结果 | |
滴管 | 试管 | |||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 | 产物为Ag2SO3 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | 产物含Cu+、Cu2+和SO32 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | 产物为 Al(OH)SO3 | ||
下列说法不正确的是
A. 现象Ⅰ对应的离子方程式:Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. 用稀硫酸证实Ⅱ沉淀中含有Cu+的实验现象是析出红色固体
C. 现象Ⅲ中白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色
D. 上述实验现象涉及了亚硫酸盐的溶解性、氧化还原性及其水溶液的酸碱性