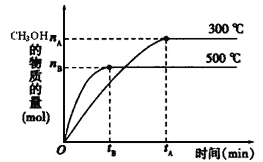
题目内容
【题目】I彩色水泥墙含氯化亚钴可作睛雨表。下表为几种氯化亚钻的晶体颜色:
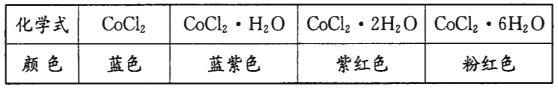
淋雨时彩色水泥墙的颜色为________。
Ⅱ从含钻废料(含CoO、Co2O3及金属Al、Li)中制取粗CoO的流程如下:
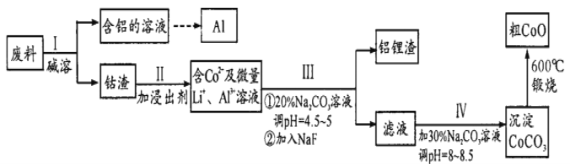
(1)步骤I产生的气体是________ (填化学式,下同),从含铝溶液中沉淀铝可通入的气体是________。
(2)步骤Ⅲ中除去A13+的离子方程式为________,步骤Ⅳ中Na2CO3溶液的作用是________(用离子方程式表示)。
(3)为了获得高纯度的钴粉,从环保角度考虑,还原Co2O3的试剂为________ (填序号)。
A.铝 B.木炭 C氢气 D.一氧化碳
(4)实验室制备氯化亚钴晶体并测其化学式的流程如下:
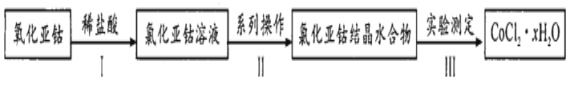
①步骤Ⅱ“系列操作”中洗涤晶体不用蒸馏水而用酒精,目的是________。
②用灼烧一称重法测定氯化亚钴晶体中结晶水含量时,需要在氯化氢氛围中灼烧结晶水合物,请结合方程式解释这样做的原因________。
③已知几种物质在20℃时的Ksp如下表:
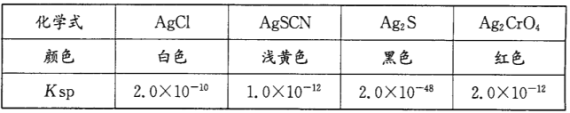
某同学用滴定法测定晶体CoCl2·xH2O中的x,常用标准硝酸银法进行滴定,滴定时选择的指示剂是________(填编号)。
A KCl B KSCN C K2S D K2CrO4
若取样品ag溶于蒸馏水中配制100mL溶液取20mL配制溶液于锥形瓶中,加入所选指示剂,用c mol / L AgNO3溶液滴定至终点消耗标准溶液bmL,则x的表达式为________。
【答案】粉红色 H2 CO2 2Al3+ + 3CO32- + 3H2O =2Al(OH)3 ↓+ 3CO2↑ CO32- +Co2+= CoCO3 ↓ C 氯化亚钴晶体在无水乙醇中的溶解度小于在蒸馏水中的溶解度,且乙醇挥发性较好 CoCl2+H2O![]() Co(OH)2+2HCl,加热时,氯化氢挥发,促进水解,得不到氯化亚钴,在氯化氢氛围中灼烧结晶水合物,可以抑制水解 D
Co(OH)2+2HCl,加热时,氯化氢挥发,促进水解,得不到氯化亚钴,在氯化氢氛围中灼烧结晶水合物,可以抑制水解 D ![]()
【解析】
I. 淋雨时彩色水泥墙上的氯化亚钴吸收水分,生成CoCl2·6H2O,结合表格数据判断;
Ⅱ.废料中加入碱溶液碱溶,得到钴渣(含CoO、Co2O3),钴渣可以用盐酸溶解,溶解生成的+3价钴离子能够氧化氯离子,得到Co2+,酸溶后的溶液中加入碳酸钠溶液和NaF溶液净化,除去锂离子和铝离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,高温煅烧,碳酸钴分解得到氧化钴,结合物质的性质和氧化还原反应的规律分析解答。
I. 淋雨时彩色水泥墙上的氯化亚钴吸收水分,生成CoCl2·6H2O颜色变成粉红色,故答案为:粉红色;
Ⅱ.废料中加入碱溶液碱溶,得到钴渣(含CoO、),钴渣可以用盐酸溶解,溶解生成的+3价钴离子能够氧化氯离子,得到Co2+,酸溶后的溶液中加入碳酸钠溶液和NaF溶液净化,除去锂离子和铝离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,高温煅烧,碳酸钴分解得到氧化钴。
(1)步骤I中铝与氢氧化钠溶液反应放出氢气,从含铝溶液(主要含有偏铝酸根离子)中沉淀铝可通入二氧化碳,生成氢氧化铝沉淀,故答案为:H2;CO2;
(2)步骤Ⅲ中A13+和碳酸根离子发生双水解反应,反应的离子方程式为2Al3+ + 3CO32- + 3H2O =2Al(OH)3 ↓+ 3CO2↑;步骤Ⅳ中Na2CO3溶液与Co2+反应生成碳酸钴沉淀,反应的离子方程式为CO32- +Co2+= CoCO3 ↓,故答案为:2Al3+ + 3CO32- + 3H2O =3Al(OH)3 ↓+ 2CO2↑;CO32- +Co2+= CoCO3 ↓;
(3)A.铝与Co2O3反应生成氧化铝,使得生成的钴粉不纯,错误;B.木炭与Co2O3反应生成二氧化碳,未反应的木炭使得生成的钴粉不纯,错误;C氢气与Co2O3反应生成水,不会污染环境,且不引入新杂质,正确;D.一氧化碳会污染空气,错误;故选C;
(4)①制得的晶体在无水乙醇中的溶解度小于在蒸馏水中的溶解度,且乙醇挥发性较好,所以用乙醇洗涤能减小晶体因溶解而损失,故答案为:氯化亚钴晶体在无水乙醇中的溶解度小于在蒸馏水水中的溶解度,且乙醇挥发性较好;
②氯化亚钴能够水解,水解的化学方程式:CoCl2+H2O![]() Co(OH)2+2HCl,加热时,氯化氢挥发,促进水解,得不到氯化亚钴,为了抑制水解,需要在氯化氢氛围中灼烧结晶水合物,故答案为:CoCl2+H2O
Co(OH)2+2HCl,加热时,氯化氢挥发,促进水解,得不到氯化亚钴,为了抑制水解,需要在氯化氢氛围中灼烧结晶水合物,故答案为:CoCl2+H2O![]() Co(OH)2+2HCl,加热时,氯化氢挥发,促进水解,得不到氯化亚钴,在氯化氢氛围中灼烧结晶水合物,可以抑制水解;
Co(OH)2+2HCl,加热时,氯化氢挥发,促进水解,得不到氯化亚钴,在氯化氢氛围中灼烧结晶水合物,可以抑制水解;
③本题的指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点。A.氯化钾与硝酸银生成氯化银沉淀,没有明显的颜色变化,故A不选;B.根据表格数据可知AgSCN的溶解度小于氯化银,首先生成AgSCN沉淀,故B不选;C. Ksp(Ag2S)= c2(Ag+)c(S2-)=2.0×10-48,c(S2-)=![]() =1.0×10-16;Ksp(AgCl)=c(Ag+)c(Cl-)=2.0×10-10,c(Cl-)=
=1.0×10-16;Ksp(AgCl)=c(Ag+)c(Cl-)=2.0×10-10,c(Cl-)=![]() ,说明硫化银的溶解度小于氯化银,滴定时首先生成Ag2S沉淀,故C不选;D.计算饱和溶液中氯离子、CrO42-的浓度,Ksp(AgCl)= c(Ag+)c(Cl-)=2.0×10-10,c(Cl-)=
,说明硫化银的溶解度小于氯化银,滴定时首先生成Ag2S沉淀,故C不选;D.计算饱和溶液中氯离子、CrO42-的浓度,Ksp(AgCl)= c(Ag+)c(Cl-)=2.0×10-10,c(Cl-)=![]() ;Ksp(Ag2CrO4)= c2(Ag+)c(CrO42-)=2.0×10-12,c(CrO42-)=
;Ksp(Ag2CrO4)= c2(Ag+)c(CrO42-)=2.0×10-12,c(CrO42-)=![]() =1.0×10-4;说明铬酸银溶解度大于氯化银,则加入K2CrO4做指示剂可正确的测定氯化物的含量,故D正确;故答案为:D;
=1.0×10-4;说明铬酸银溶解度大于氯化银,则加入K2CrO4做指示剂可正确的测定氯化物的含量,故D正确;故答案为:D;
(4)消耗的硝酸银的物质的量为cmol / L×b×10-3L=bc×10-3mol,根据Ag++Cl-=AgCl↓,氯化亚钴的物质的量为![]() ×bc×10-3mol,则
×bc×10-3mol,则![]() ×x×
×x×![]() =
=![]() ×bc×10-3mol,解得:x=
×bc×10-3mol,解得:x=![]() ,故答案为:
,故答案为:![]() 。
。

【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示:
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
下列关系不正确的是
A. 酸性:H2CO3 > ![]()
B. 水电离产生的c(H+):① = ②
C. 溶液③中:c(HCO3﹣)+ c(CO32﹣)+ c(H2CO3)= 0.1molL﹣1
D. 溶液④中:c(Na+)> c(![]() )> c(OH-)> c(H+)
)> c(OH-)> c(H+)
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
① H2O2的分解反应________氧化还原反应(填“是”或“不是”).
②该分解反应0─20min的平均反应速率v(H2O2)为________molL﹣1 min﹣1 .
③如果反应所用的H2O2溶液为100mL,则共产生O2________g.
A.0.08 B.0.16 C.1.28 D.2.4.
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液为实验对象,可探究盐的性质和盐溶液间反应的多样性
实验 | 试剂 | 现象 | 检验 结果 | |
滴管 | 试管 | |||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 | 产物为Ag2SO3 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | 产物含Cu+、Cu2+和SO32 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | 产物为 Al(OH)SO3 | ||
下列说法不正确的是
A. 现象Ⅰ对应的离子方程式:Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. 用稀硫酸证实Ⅱ沉淀中含有Cu+的实验现象是析出红色固体
C. 现象Ⅲ中白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色
D. 上述实验现象涉及了亚硫酸盐的溶解性、氧化还原性及其水溶液的酸碱性