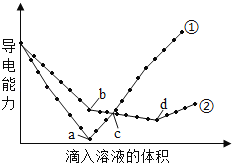
��Ŀ����
����Ŀ��(1)��ͼ��ʾ����ԭ��ص�װ��ͼ����ش�
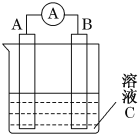
��CΪϡH2SO4��Һ��������ָ�뷢��ƫת��B�缫����ΪFe������������A�缫�Ϸ����ĵ缫��ӦʽΪ______�����ӵ��ƶ�������______________����Ӧ����һ��ʱ�����ҺC��������Ũ�Ƚ�________(����ߡ��������͡��������䡱)��
(2)��ͼ��һ��˫Һԭ���װ��ͼ������˵����ȷ����__________��
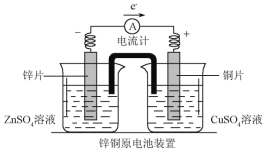
A.�����е���������CuSO4��Һ���ƶ� B.���ŵ�����֮һ��ƽ����
C.ͭƬ����صĸ��� D.�õ�رȵ�Һԭ��صĵ������ȶ�
(3)�״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ��ʹ�ã���CH3OH��O2����γɵ����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ���£�
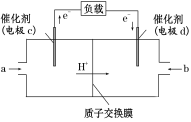
����ܷ�ӦΪ2CH3OH��3O2===2CO2��4H2O����C�缫��________(�������������)��C�缫�ķ�Ӧ����ʽΪ_______________������·��ת��3 mol���ӣ�������CH3OHȼ�ϵ�أ����ĵ�CH3OH������Ϊ_____g��
���𰸡�2H����2e��===H2����Fe�缫�ص�������A������B D����CH3OH��6e����H2O===CO2��6H��16
��������
��1��B�缫Ϊ��������A�缫Ϊ������A�缫��H+�����õ��ӵĻ�ԭ��Ӧ��A�缫�ϵĵ缫��ӦʽΪ2H++2e-=H2���������ɸ����ص����������������ӵ��ƶ������ǣ���Fe�缫�ص�������A�缫�������缫��ӦʽΪFe-2e-=Fe2+�������缫��ӦʽΪ2H++2e-=H2��������ܷ�ӦΪFe+2H+=Fe2++H2��������H+�����ģ���Ӧ����һ��ʱ�����ҺC��H+Ũ�Ƚ����͡�
��2������װ��ͼ��ZnƬΪ������CuƬΪ������
A�ԭ����У����������ƶ��������е���������ZnSO4��Һ���ƶ���A�����
B������缫��ӦΪZn-2e-=Zn2+�������е���������ZnSO4��Һ���ƶ��������缫��ӦʽΪCu2++2e-=Cu�������е���������CuSO4��Һ���ƶ������ŵ��������γɱպϻ�·��ƽ����ʹ������Һ���ֵ�������B����ȷ��
C���������������ͭƬ����ص�������C�����
D���˫Һԭ�����Zn��CuSO4��Һ��ֱ�ӽӴ���ʹ������ʹ���ߵ���Һ���ֵ����ԣ������˵���ͨ�����ߴ�пƬ��ͭƬ�IJ���ת�ƣ�ʹZn���ܽ��Cu���������̵��Լ������У��γɳ����ȶ��ĵ������ڵ�Һԭ�������Zn��CuSO4��Һֱ�ӽӴ���Zn����CuSO4��Һֱ�ӷ����û���Ӧʹ���ֻ�ѧ��ת��Ϊ���ܣ�Cu��ZnƬ�����������谭Zn����Һ�ĽӴ�����ʹ��������ĵ���ǿ�ȼ�����˫Һԭ��صĵ����ȵ�Һԭ��صĵ������ȶ���D����ȷ��
��ѡBD��
��3�����ݵ��ӵ�����H+�����������缫cΪ�������缫dΪ����������ܷ�ӦΪ2CH3OH+3O2=2CO2+4H2O���缫c��CH3OH����ʧ���ӵ�������Ӧ����CO2��c�缫�ĵ缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+�����ݵ缫��Ӧʽ������ÿ����1molCH3OH��·��ת��6mol��������·��ת��3mol��������������CH3OH���ʵ���Ϊ0.5mol������CH3OH������Ϊ0.5mol��32g/mol=16g��

����Ŀ��һ�������£�H2O2��ˮ��Һ�з����ֽⷴӦ��2H2O2![]() 2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
t/min | 0 | 20 | 40 | 60 | 80 |
c��H2O2��/molL��1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
�� H2O2�ķֽⷴӦ________������ԭ��Ӧ����ǡ����ǡ�����
�ڸ÷ֽⷴӦ0��20min��ƽ����Ӧ����v��H2O2��Ϊ________molL��1 min��1 ��
�������Ӧ���õ�H2O2��ҺΪ100mL������O2________g��
A��0.08 B��0.16 C��1.28 D��2.4��
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������ҺΪʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ�����
ʵ�� | �Լ� | ���� | ���� ��� | |
�ι� | �Թ� | |||
2 mL | 0.2 mol��L1 Na2SO3��Һ | ����Ag2SO4��Һ | ��.������ɫ���� | ����ΪAg2SO3 |
0.2 mol��L1 CuSO4 | ��.��Һ���̣������μӲ����ػ�ɫ���� | ���ﺬCu+��Cu2+��SO32 | ||
0.1 mol��L1 Al2(SO4)3��Һ | ��.��ʼ�����Ա仯�������μӲ�����ɫ���� | ����Ϊ Al(OH)SO3 | ||
����˵������ȷ����
A. ������Ӧ�����ӷ���ʽ��Ag2SO4(s) + SO32(aq) === Ag2SO3(s) + SO42(aq)
B. ��ϡ����֤ʵ������к���Cu+��ʵ��������������ɫ����
C. ������а�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ
D. ����ʵ�������漰���������ε��ܽ��ԡ�������ԭ�Լ���ˮ��Һ�������