题目内容
18.已知反应:①101KPa时,2C(s)+O2(g)=2CO(g);△H=-221KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热等于110.5KJ/mol | |
| B. | 2C(s)+2O2(g)=2CO2(g);△H>-221 KJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 KJ |
分析 A、CO燃烧生成二氧化碳继续放出热量;
B、CO燃烧生成二氧化碳继续放出热量,焓变包含符号并且与系数成正比;
C、浓硫酸稀释放出大量的热;
D、醋酸是弱电解质,电离需吸收热量;
解答 解:A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,故A错误;
B、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以2mol碳完全燃烧放出的热量大于221 kJ,即2C(s)+2O2(g)=2CO2(g);△H<-221 KJ/mol,故B错误;
C、浓硫酸稀释放出大量的热,浓硫酸与稀NaOH溶液完全反应生成1mol水时放出的热量大于57.3 kJ,故C错误;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D正确;
故选D;
点评 考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意强酸、强碱的稀溶液中和热为57.3kJ/mol.

练习册系列答案
相关题目
9.下列有关化学实验的叙述中,不正确的是( )
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
6.下列说法错误的是( )
| A. | 鸡蛋清和淀粉可以用浓硝酸鉴别 | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(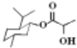 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
3. 硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
 硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )
硝苯地平缓释片(简称NSRT)是一种用于治疗各种类型的高血压及心绞痛的新药,其结构式如图所示.下列关于硝苯地平缓释片的说法正确的是( )| A. | NSRT的分子式为C18H17N2O6 | |
| B. | 1molNSRT在水溶液中最多能消耗2molNaOH | |
| C. | NSRT不能使酸性高锰酸钾溶液褪色 | |
| D. | 1mol NSRT在一定条件下能和7molH2发生加成反应 |
10.下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | Cl2+H2O?HC1+HC1O | D. | Na2CO3+BaC12=BaCO3↓+2NaC1 |
8.有A、B、C、D四种金属,分别把它们加入到稀盐酸中,A、B、D反应后有气体放出,C无明显现象,再把A、D加入B盐溶液中,D表面有B析出,而A没有,则四种金属的活动性顺序是为( )
| A. | A>B>D>C | B. | B>D>A>C | C. | D>B>A>C | D. | D>A>B>C |
 $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O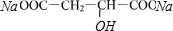 +2H2O+2CO2↑
+2H2O+2CO2↑ ,
, (或
(或 ).
).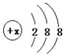 有几种元素的微粒电子层结构如图所示,其中:
有几种元素的微粒电子层结构如图所示,其中: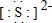 .
. .
.