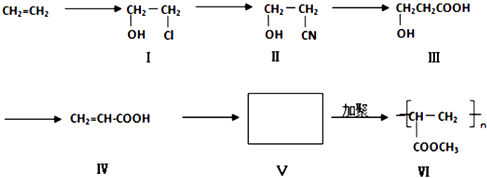
题目内容
【题目】CH4既是一种重要的能源,也是一种重要的化工原料.
(1)已知8.0g CH4完全燃烧生成液体水放出444.8kJ热量.则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=kJmol﹣1
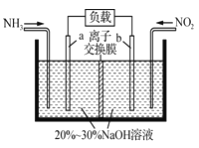
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理图1所示,则通入a气体的电极名称为 , 通入b气体的电极反应式为 . (质子交换膜只允许H+通过)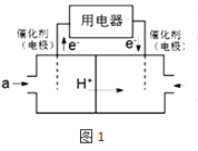
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向.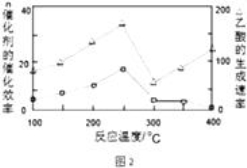
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在 左右.
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2 , 难溶物).将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 .
(4)CH4还原法是处理NOx气体的一种方法.已知一定条件下CH4与NOx反应转化为N2和CO2 , 若标准状况下8.96L CH4可处理22.4L NOx,则x值为 .
【答案】
(1)﹣889.6
(2)负极;O2+4e﹣+4H+=2H2O
(3)250℃;3 CuAlO2+16 H++NO3﹣=NO↑+3 Al3++3Cu2++8H2O
(4)1.6
【解析】解:(1)已知8.0g CH4完全燃烧生成液体水放出444.8kJ热量,则1mol即16g燃烧放出的热量为 ![]() ×444.8kJ=889.6kJ,反应放热,则故△H=﹣889.6kJ/mol;
×444.8kJ=889.6kJ,反应放热,则故△H=﹣889.6kJ/mol;
所以答案是:﹣889.6;
(2.)由图可知,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下结合氢离子生成水,正极电极反应式为:O2+4e﹣+4 H+=2H2O,
负极; O2+4e﹣+4H+=2H2O;
(3.)①从图象可知:250℃时乙酸反应速率最大、催化活性,故选择250℃;
所以答案是:250℃;②CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为:3 CuAlO2+16 H++NO3﹣=NO↑+3 Al3++3Cu2++8H2O;
所以答案是:3 CuAlO2+16 H++NO3﹣=NO↑+3 Al3++3Cu2++8H2O;
(4.)根据得失电子转移守恒,则:8.96L×[4﹣(﹣4)]=22.4L×2x,解得x=1.6;
所以答案是:1.6.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得. 
(1)氨气的发生装置可以选择如图1中的 , 反应的化学方程式为 .
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是 .
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案(填“合理”或“不合理”),请分析:(如合理,说明原因;如不合理,说明原因并设计改进方案).
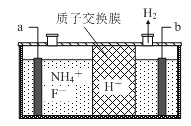
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③ | ④ |
【题目】FeCl3,又名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_______________________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_______mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =_______mol/L.
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为__________________;高铁酸钠Na2FeO4是一种新型水处理剂,用FeCl3制备的离子方程式如下,请完成该方程式的配平:___Fe3++_____Cl 2+_____OH-=_____FeO42-+_____Cl-+_____H2O
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
A | B | C | |
加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
加入钠 | 放出氢气 | 放出氢气 | 不反应 |
苯环上一氯代物的种数 | 2 | 3 | 3 |
则B的结构简式为____,A与浓溴水反应的方程式为___________。