��Ŀ����
����Ŀ��������ୣ��ṹʽ��ͼ��ʾ����һ�ֿ�ű��ҩ���ҩ������ϸ��ˮƽ�϶�����״���������������á�����������ף��Ƽ���������Ƴ���������୵�һ�ֺϳ�·�ߡ�

�ϳ�·�����£�
��֪��
i. 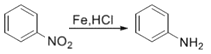
ii. 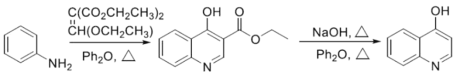
iii.�л��ṹ���ü���ʽ��ʾ����CH3CH(NH2)(CH2)3N(CH2CH3)2�ļ���ʽ�ɱ�ʾΪ
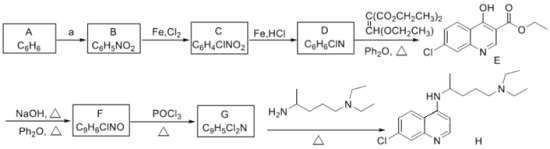
(1)A��һ�ַ�������A��B�ķ�Ӧ�Լ�a_____________________��
(2)B��Ӧ����C�ķ�Ӧ��ѧ����ʽ��____________________________________________��
(3)D�Ľṹ��ʽΪ___________________________��
(4)F�����_____________��ԭ�ӹ�ƽ�棬F��G��Ӧ����Ϊ_____________________��
(5)I��E��ͬ���칹�壬д������2�ַ�������������I�Ľṹ��ʽ��___________________�������������칹����
��I����ȡ���ķ����廯�����ͬ�����ŵ�ȡ��λ����E��ͬ���������� �����еIJ��֣���
�����еIJ��֣���
�ں˴Ź�����������I���˷��㻷�����⣬����5��壬�������3:1:1:1:1��
��I����NaHCO3��Һ�������塣
(6)6-������-4-����������Ұ������ ������Ѫ���没��ҩ���������D��H�ĺϳ�·�ߣ����һ����4-����������
������Ѫ���没��ҩ���������D��H�ĺϳ�·�ߣ����һ����4-���������� ��N,N����������Ҷ���
��N,N����������Ҷ��� Ϊ��ʼԭ�ϣ������Լ���ѡ�����Ʊ�6-������-4-����������Ұ�������ĺϳ�·��_______________________________________________________��
Ϊ��ʼԭ�ϣ������Լ���ѡ�����Ʊ�6-������-4-����������Ұ�������ĺϳ�·��_______________________________________________________��
���𰸡�Ũ�����Ũ���� 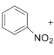 +Cl2
+Cl2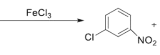 +HCl
+HCl ![]() 18 ȡ����Ӧ
18 ȡ����Ӧ  ��
��

��������
A��һ�ַ��㾭����AΪ�����������кϳ�·�߽�ϸ����ʵĻ�ѧʽ��֪��A��Ũ���ᡢŨ����������·���������Ӧ��BΪ![]() ��B����ȡ����Ӧ����CΪ
��B����ȡ����Ӧ����CΪ![]() ��C������ԭ��Ӧ��DΪ
��C������ԭ��Ӧ��DΪ![]() ��D����������Ϣ�е�������Ӧ��FΪ
��D����������Ϣ�е�������Ӧ��FΪ ��F����ȡ����Ӧ����GΪ
��F����ȡ����Ӧ����GΪ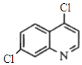 ��G�ٷ���ȡ����H��
��G�ٷ���ȡ����H��
��1��A��һ�ַ�������A��Ũ���ᡢŨ����������·���������Ӧ��BΪ![]() ��A��B�ķ�Ӧ�Լ�aΪŨ�����Ũ���ᡣ�ʴ�Ϊ��Ũ�����Ũ���
��A��B�ķ�Ӧ�Լ�aΪŨ�����Ũ���ᡣ�ʴ�Ϊ��Ũ�����Ũ���
��2��B����ȡ����Ӧ����C����Ӧ��ѧ����ʽ�� +Cl2
+Cl2 +HCl���ʴ�Ϊ��
+HCl���ʴ�Ϊ�� +Cl2
+Cl2 +HCl��
+HCl��
��3����������ķ�����֪��C������ԭ��Ӧ��D��D�Ľṹ��ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4��FΪ ��������9��C��1��Cl��1��N��6��H��1��O�����ܹ��棬F�����18��ԭ�ӹ�ƽ�棬F����ȡ����Ӧ����GΪ
��������9��C��1��Cl��1��N��6��H��1��O�����ܹ��棬F�����18��ԭ�ӹ�ƽ�棬F����ȡ����Ӧ����GΪ ��F��G��Ӧ����Ϊȡ����Ӧ���ʴ�Ϊ��18��ȡ����Ӧ��
��F��G��Ӧ����Ϊȡ����Ӧ���ʴ�Ϊ��18��ȡ����Ӧ��
��5��I��E��ͬ���칹�壬��I����ȡ���ķ����廯�����ͬ�����ŵ�ȡ��λ����E��ͬ����������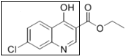 �����еIJ��֣������Ȼ���λ�ÿ����ƶ����ں˴Ź�����������I���˷��㻷�����⣬����5��壬�������3:1:1:1:1����������λ�õ��⣻��I����NaHCO3��Һ�������壬�����Ȼ�������E ������ͬ�Ļ�״�ṹ��E��ͬ���칹�壬���E�Ľṹ��ʽ��֪������������I�Ľṹ��ʽ��
�����еIJ��֣������Ȼ���λ�ÿ����ƶ����ں˴Ź�����������I���˷��㻷�����⣬����5��壬�������3:1:1:1:1����������λ�õ��⣻��I����NaHCO3��Һ�������壬�����Ȼ�������E ������ͬ�Ļ�״�ṹ��E��ͬ���칹�壬���E�Ľṹ��ʽ��֪������������I�Ľṹ��ʽ��  ��
�� �������������칹�����ʴ�Ϊ��
�������������칹�����ʴ�Ϊ�� ��
�� ��
��
��6��ģ��D��E��4-����������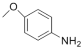 ��
��![]() ��Ӧ����
��Ӧ����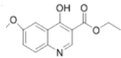 ����ģ��E����F�ķ�Ӧ�ϳ�
����ģ��E����F�ķ�Ӧ�ϳ�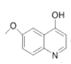 ��
�� ����ȡ����Ӧ��
����ȡ����Ӧ��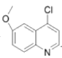 ����N,N����������Ҷ���
����N,N����������Ҷ��� ����ȡ����Ӧ���Ʊ�6-������-4-����������Ұ���������ϳ�·��
����ȡ����Ӧ���Ʊ�6-������-4-����������Ұ���������ϳ�·��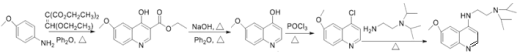 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

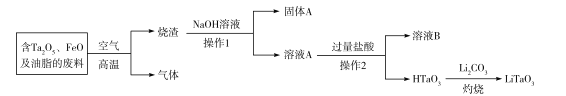
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������������������Ⱦ���е�NOx��SO2�������Ϊ���ǹ�ע����Ҫ����֮һ��
(1)SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2��
��֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)= NH4HSO3(aq) ��H1= a kJ/mol��
��NH3��H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ��H2= b kJ/mol��
��2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ��H3= c kJ/mol��
��Ӧ2SO2(g)+ 4NH3��H2O(aq)+ O2(g) = 2(NH4)2SO4(aq)+ 2H2O(l)����H=______kJ/mol��
(2)ȼú���糧�����÷�Ӧ2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ��H =681.8 kJ/mol��ú����������������SO2���ŷš����ڸ÷�Ӧ�����¶�ΪTKʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
2CaSO4(s)+2CO2(g) ��H =681.8 kJ/mol��ú����������������SO2���ŷš����ڸ÷�Ӧ�����¶�ΪTKʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ��/min Ũ��/mol��L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
��0��20 min�ڣ�ƽ����Ӧ����v(SO2)=_____mol/(L��min)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⡣�����ϱ��е������жϣ��ı������������_____������ĸ����
A��ͨ��һ������O2 B������һ�����ķ�״̼���
C���ʵ���С��������� D�������Ч�Ĵ���
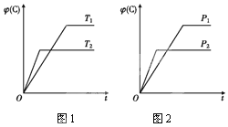
(3)NOx���ŷ���Ҫ����������β�����������÷�ӦC(s)+2NO(g)![]() N2(g)+CO2(g) ��H=34.0 kJ/mol���û���̿��NO����������
N2(g)+CO2(g) ��H=34.0 kJ/mol���û���̿��NO����������
����֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��

��ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����{��������ԭ��Ϊ________________________________��
����ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp������1050K��1.1��105Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=_____________________ [��֪�������ѹ(P��)=������ѹ(P)���������]��
(4)��������Ҳ����������[(NH2)2CO]ˮ��Һ���ա�������[(NH2)2CO]ˮ��Һ���������Ϊ1��1��NO��NO2��������ɽ�NԪ��ת��Ϊ�Ի����������塣�÷�Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(5)����β�����ջ������÷�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=746.8 kJ/mol��ʵ���ã�v��= k����c2(NO)��c2(CO)��v��= k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
N2(g)+2CO2(g) ��H=746.8 kJ/mol��ʵ���ã�v��= k����c2(NO)��c2(CO)��v��= k����c(N2)��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���_________������>����<������=����k������ı�����
������1L�ĺ����ܱ������г���1 molCO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ80%����k���Uk��=_____L/mol��