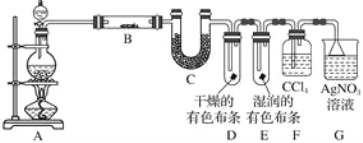
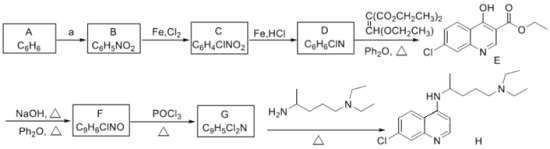
题目内容
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
Si(s)+4HCl(g);△H= +mkJ/mol(m>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为m kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025m kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
【答案】D
【解析】
A.从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于mkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)=![]() =0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)=
=0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)=![]() ×v(HCl)=
×v(HCl)=![]() ×0.03mol/(Lmin) =0.015mol/(Lmin),故C错误;
×0.03mol/(Lmin) =0.015mol/(Lmin),故C错误;
D.由方程式可知,当反应吸收热量为0.025mkJ时,生成HCl的物质的量为![]() ×4=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
×4=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D。

【题目】下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____,直到因加入一滴盐酸后,溶液由______色变为____色,并____为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,所用盐酸溶液的体积为_____mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 25.31 | 25.09 |
依据表中数据列式计算该NaOH溶液的物质的量浓度_____(保留两位小数)。