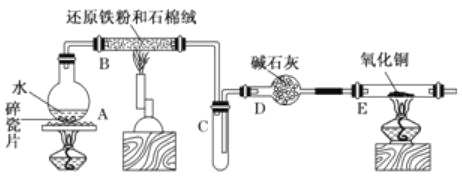
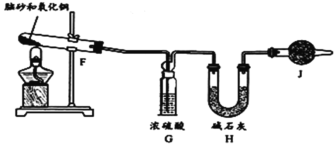
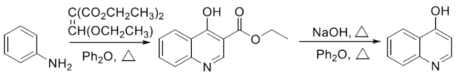
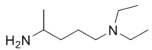
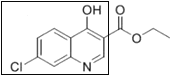
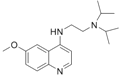
题目内容
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:
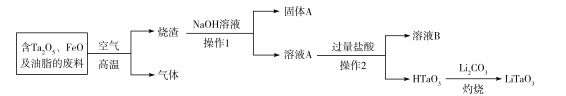
(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
【答案】+5 Fe2O3 制作颜料 过滤 AgNO3和稀硝酸 d ![]() 47.2
47.2
【解析】
含Ta2O5、FeO及油脂的废料在空气中高温出去油脂将FeO氧化为Fe2O3,加NaOH溶液得NaTaO3过量盐酸得HTaO3,再加Li2CO3灼烧得LiTaO3。
(1)化合价可通过化合价代数和为零计算;
(2)固体A为Fe2O3,可用于制作颜料;
(3)操作2为过滤,溶液B中含有阴离子为Cl-;
(4)由操作2过滤可知HTaO3为难溶性酸,溶液A中含有TaO3-与盐酸反应生成HTaO3,HTaO3为弱酸;
(5)NaOH与Ta2O5反应生成NaTaO3和H2O;
(6)通过元素质量守恒计算。
(1)LiTaO3中钽的化合价为X=0-(+1)-(-2)×3=+5,故答案为:+5;
(2)固体A为Fe2O3,可用于制作颜料;故答案为:Fe2O3;制作颜料;
(3)操作2用于分离溶液B和固体HTaO3,故操作2为过滤;溶液B中含有阴离子为Cl-,可用AgNO3和稀硝酸来鉴别;故答案为:过滤;AgNO3和稀硝酸;
(4)由操作2过滤可知HTaO3为难溶性酸,溶液A中含有TaO3-与盐酸反应生成HTaO3,HTaO3为弱酸;故答案为:d;
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为![]() ;故答案为:
;故答案为:![]() ;
;
(6)100kg该废料中含Ta2O5质量![]() 则Ta2O5物质的量
则Ta2O5物质的量![]() ,则LiTaO3物质的量为200mol,LiTaO3质量
,则LiTaO3物质的量为200mol,LiTaO3质量![]() ;故答案为:47.2。
;故答案为:47.2。

【题目】下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④