题目内容
【题目】① NaOH ② CH3COOH ③ NaHCO3 ④ HCl溶液是中学化学中常用的四种物质。
(1)pH相同的CH3COOH和HCl溶液比较,物质的量浓度较大的是____(填序号)。
(2)等体积、等物质的量浓度的CH3COOH和HCl溶液与足量的NaHCO3固体粉末反应,起始反应速率较小的是_______填序号)。
(3)常温下,pH均为10的 NaOH和NaHCO3 溶液,由水电离出的c(OH—)之比为_________________。
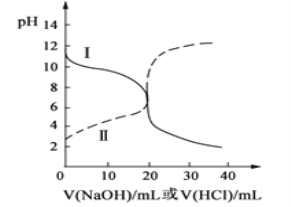
(4)常温下,用 0.10 mol/L NaOH溶液滴定 20.00 mL 0.10 mol/L CH3COOH溶液,
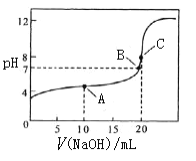
①A点溶质为____________(写化学式),此时c(CH3COO-)_______c(CH3COOH)(填“大于” 、“小于”或“等于”),溶液中水的电离平衡______(填“被抑制”或“被促进”或“无影响”)
②结合化学用语,解释C点pH=8的原因_______________________________________ 。
③下列关于B点的判断正确的是____
a.醋酸和氢氧化钠恰好完全反应
b.混合液中的微粒种类共四种
c.c(CH3COO-) = c(Na+)
【答案】② ② 1:106 CH3COONa、CH3COOH 大于 被抑制 C点20.00mL 0.10mol/LNaOH溶液和20.00mL0.10 mol/LCH3COOH溶液恰好完全反应生成CH3COONa,CH3COO-在溶液中水解CH3COO-+H2O![]() CH3COOH+OH-,使溶液显碱性,溶液pH=8 C
CH3COOH+OH-,使溶液显碱性,溶液pH=8 C
【解析】
(1)pH相同溶液中氢离子浓度相同,醋酸是弱酸部分电离,HCl是强酸完全电离;
(2)与足量的NaHCO3固体粉末反应,起始溶液中氢离子浓度越大,反应速率越快;
(3)氢氧化钠是强碱,电离出的氢氧根抑制水电离,碳酸氢钠是强碱弱酸盐,碳酸氢根在溶液中水解促进水电离;
(4)由图可知,用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,A点为半反应点,得到等浓度的醋酸和醋酸钠混合液,溶液显酸性,B点为中性点,得到的是醋酸和醋酸钠混合液,C点为完全反应点,得到醋酸钠溶液,溶液显碱性。
(1)pH相同的CH3COOH和HCl溶液中氢离子浓度相同,若溶液中氢离子浓度为1mol/L,CH3COOH是弱酸,部分电离,CH3COOH溶液浓度应大于1mol/L;HCl是强酸,完全电离,盐酸溶液浓度为1mol/L,物质的量浓度较大的是CH3COOH溶液,故答案为:②;
(2)等体积、等物质的量浓度的CH3COOH和HCl溶液相比较,HCl溶液中氢离子浓度大于CH3COOH溶液,与足量的NaHCO3固体粉末反应,起始反应速率HCl溶液快、CH3COOH溶液慢,故答案为:②;
(3)氢氧化钠是强碱,电离出的氢氧根抑制水电离,氢氧化钠溶液中水电离出的氢氧根离子浓度等于氢离子浓度,则pH均为10的氢氧化钠溶液中水电离出的c(OH-)=c(H+)=10-10mol/L,碳酸氢钠是强碱弱酸盐,碳酸氢根在溶液中水解促进水电离,溶液中氢氧根离子就是水电离出的氢氧根离子,所以由水电离出的c(OH-)=10-14/10-10mol/L=10-4mol/L,由水电离出的c(OH—)之比为10-10mol/L:10-4mol/L=1:106,故答案为:1:106;
(4)由图可知,用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,A点为半反应点,得到等浓度的醋酸和醋酸钠混合液,溶液显酸性,B点为中性点,得到的是醋酸和醋酸钠混合液,C点为完全反应点,得到醋酸钠溶液,溶液显碱性。
①用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,A点为半反应点,得到等浓度的醋酸和醋酸钠混合液,溶液显酸性,说明醋酸电离大于醋酸根水解,c(CH3COO-)大于c(CH3COOH),醋酸电离出的氢离子抑制水的电离,故答案为:CH3COONa、CH3COOH;大于;被抑制;
②用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,C点为完全反应点,得到醋酸钠溶液,醋酸根在溶液中水解CH3COO-+H2O![]() CH3COOH+OH-,使溶液显碱性,溶液pH=8,故答案为:C点20.00mL 0.10mol/LNaOH溶液和20.00mL0.10 mol/LCH3COOH溶液恰好完全反应生成CH3COONa,CH3COO-在溶液中水解CH3COO-+H2O
CH3COOH+OH-,使溶液显碱性,溶液pH=8,故答案为:C点20.00mL 0.10mol/LNaOH溶液和20.00mL0.10 mol/LCH3COOH溶液恰好完全反应生成CH3COONa,CH3COO-在溶液中水解CH3COO-+H2O![]() CH3COOH+OH-,使溶液显碱性,溶液pH=8;
CH3COOH+OH-,使溶液显碱性,溶液pH=8;
③a、用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,B点为中性点,得到的是醋酸和醋酸钠混合液,故错误;
b、醋酸和醋酸钠混合液中存在的微粒有H2O和CH3COOH两种分子,Na+、CH3COO-、OH-和H+四种离子,故错误;
c、醋酸和醋酸钠混合液中存在电荷守恒关系:c(Na+)+ c(H+)= c(CH3COO-)+c(OH-),由于中性溶液中c(H+)=(OH-),则c(CH3COO-) = c(Na+),故正确;
故选c,故答案为:c。