题目内容
【题目】现有CO和CO2的混合气体20克,其在标准状况下的体积为11.2L。据此回答下列问题:
(1)该混合气体总的物质的量为______,其平均摩尔质量为_______。
(2)混合气体中碳原子的个数为________。(用NA表示阿伏加德罗常数的值)
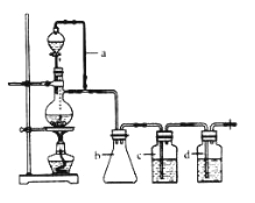
(3)若将该混合气体全部通过下图装置进行实验。

则:①气球中收集的气体是______,其质量为_______ 克
②从A瓶中获得沉淀质量的操作是_____、称量。
③若要证明A瓶溶液中的阳离子是否沉淀完全,其方法为_______。
【答案】0.5mol 40g/mol 0.5NA CO 3.5克 过滤、洗涤、干燥 待A瓶中充分沉淀后,取上层清液少许于一支洁净试管中,再滴加稀硫酸溶液,若有白色沉淀产生,说明Ba2+未沉淀完全;反之,则Ba2+已沉淀完全。(其它合理答案也给分)
【解析】
试题本题以CO和CO2混合气体的研究为基础,考查物质的量计算、平均摩尔质量的计算、微粒数计算、CO及CO2的性质、物质的分离实验方案、离子检验等基础知识,考查考生有关物质的量的综合计算能力、实验分析能力和运用所学知识解决实际问题的能力。
解析:(1)设混合气体中CO为x mol,CO 为y mol,则28x+44y=20,x+y=11.2/22.4=0.5,解得x=0.125mol,y=0.375mol。M(平均)=20g/0.5mol=40g/mol。正确答案:0.5mol、40g/mol。(2)无论CO还是CO2,每个分子中都只含有1个C 原子,所以混合气体中C原子数等于气体的物质的量为0.5mol,既0.5NA。正确答案:0.5NA。(3)根据图示,混合气体通过Ba(OH)2溶液后,CO2气体被吸收生成BaCO3沉淀,再经过浓硫酸干燥,气球中收集到的是CO气体,其质量为0.125mol×28g/mol=0.35g。从A瓶中得到BaCO3沉淀可以先过滤分离出沉淀,再洗涤、干燥即可。A瓶中的阳离子是Ba2+,检验方法是取上层清液,加入Na2SO4,如果没有白色沉淀产生则说明Ba2+已经完全沉淀,如果有白色沉淀产生则说明Ba2+没有完全沉淀。正确答案:3.5g、过滤,洗涤,干燥、待A瓶中充分沉淀后,取上层清液少许于一支洁净试管中,再滴加的稀硫酸溶液,若有白色沉淀产生,说明Ba2+未沉淀完全;反之,则Ba2+已沉淀完全。

【题目】在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为____________(填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K =_________________________________。
(3)能说明该反应达到化学平衡状态的是________________(填字母)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,
测得 c(CO) = 0.0080 mol/L ,则CO2的转化率为______________。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ___________℃。