题目内容
【题目】已知Cu2O在酸性条件下易歧化且2Cu2++4I-=2CuI↓+I2;碘单质易溶于碘化钾形成I3—,I3—极易被碘化亚铜吸附。请搭建合适的装置制备二氧化硫并定性与定量的探究其与氧化铜反应的产物。
(一)探究二氧化硫与氧化铜反应
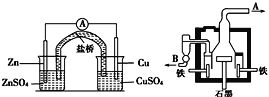
(1)下列仪器按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):A-D-____。
(2)装置B使用消泡膜的目的是____。
(3)充分反应后,硬质玻璃管中黑色固体变红色,取产物少许,加水后部分固体溶解,溶液呈蓝色,过滤红色沉淀物洗涤干净后,加硫酸溶解后溶液也呈蓝色且仍有少量红色难溶物。写出硬质玻璃管中发生的化学方程式____。
(二)碘量法测定硫酸铜的质量分数。
步骤1:配制并标定Na2S2O3标准溶液,其浓度为a molL—1。
步骤2:取硬质玻璃管产物mg配制为250mL溶液。(Cu2O不溶于水,已过滤掉)
步骤3:取20.00mL溶液,滴加几滴硫酸溶液并加入过量碘化钾溶液,以淀粉溶液作指示剂用硫代硫酸钠标准溶液滴定,消耗体积为VmL,接近终点时加入了硫氰化钾溶液。(I2+2Na2S2O3=Na2S4O6+2NaI)
(4)Na2S2O3溶液需要标定的原因是____,配制该溶液时需要用到的玻璃仪器有试剂瓶、烧杯、____和玻璃棒。
(5)通过上述测定产物中硫酸铜质量分数为____(用含字母的代数式表示),该测定值比实际值____(填“偏小”或“偏大”),原因是____,加入了硫氰化钾溶液的原因可能是____,从而减少实验误差。
【答案】BEC 防止硫酸进入硬质玻璃管 3CuO+SO2![]() Cu2O+CuSO4 硫代硫酸钠溶液由于具有较强的还原性以及酸性条件下易分解等性质而易变质 量筒
Cu2O+CuSO4 硫代硫酸钠溶液由于具有较强的还原性以及酸性条件下易分解等性质而易变质 量筒 ![]() 偏小 碘单质易溶于碘化钾形成的I3-离子极易被碘化亚铜吸附(I3-极易被碘化亚铜吸附) 使碘化亚铜转化为对I3-吸附能力弱的CuSCN
偏小 碘单质易溶于碘化钾形成的I3-离子极易被碘化亚铜吸附(I3-极易被碘化亚铜吸附) 使碘化亚铜转化为对I3-吸附能力弱的CuSCN
【解析】
(一)实验室制备二氧化硫并用二氧化硫还原氧化铜,首先是用70%的浓硫酸与亚硫酸钠固体反应制气、除杂、与氧化铜反应、尾气处理;充分反应后,硬质玻璃管中黑色固体变红色,红色物质可能是Cu或Cu2O,根据加水溶解溶液呈蓝色,说明生成的产物中有CuSO4,过滤后的红色物质加稀硫酸,沉淀部分溶解,且溶液呈蓝色且仍有少量红色难溶物,说明过滤后的红色物质为Cu2O;
(二)碘量法测定硫酸铜的质量分数,由方程式2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=Na2S4O6+2NaI,结合方程式确定硫酸铜与Na2S2O3的物质的量之间关系,根据关系式法Cu2+ ~ Na2S2O3,结合题中的信息,碘单质易溶于碘化钾形成I3-,I3-极易被碘化亚铜吸附,进行误差分析。
(1)A、D装置相连构成制取SO2气体的发生装置,B装置盛装浓硫酸,干燥二氧化硫,干燥的二氧化硫通入E中与氧化铜在加热的条件下反应,装置C是尾气处理装置,吸收未反应完的二氧化硫,故仪器的连接顺序为A-D-B-E-C;
(2)装置B使用消膜泡的作用是应该是使二氧化硫气体能平缓的进入装置E,防止B中浓硫酸进入装置E中;
(3)充分反应后,硬质玻璃管中黑色固体变红色,取产物少许,加水后部分固体溶解,溶液呈蓝色,说明溶液中含有Cu2+,过滤红色沉淀物洗涤干净后,加硫酸溶解后溶液也呈蓝色且仍有少量红色难溶物,则过滤的红色物质为Cu2O,所以SO2与CuO发生氧化还原反应,生成Cu2O和CuSO4,反应方程式为3CuO+SO2![]() Cu2O+CuSO4;
Cu2O+CuSO4;
(4)硫代硫酸钠由于具有较强的还原性以及酸性条件下易分解等性质而易变质,为了减少滴定误差,故配制好的的硫代硫酸钠溶液需要标定;标准溶液滴定前需要标定,不需要特别精准体积的容量瓶,故配置时选取量筒即可;
(5)由方程式2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=Na2S4O6+2NaI可知,Cu2+ ~ Na2S2O3,又因为取硬质玻璃管产物mg配制为250mL溶液,取20.00mL溶液,故可以得出mg生成物中硫酸铜的质量分数为![]() ;因为CuI沉淀对I3-具有强的吸附能力,会造成碘单质实际消耗量偏少,由此造成硫酸铜质量分数测定值偏小;为了减小CuI对I3-的吸附,加入了硫氰化钾溶液使碘化亚铜转化为对I3-吸附能力弱的CuSCN;
;因为CuI沉淀对I3-具有强的吸附能力,会造成碘单质实际消耗量偏少,由此造成硫酸铜质量分数测定值偏小;为了减小CuI对I3-的吸附,加入了硫氰化钾溶液使碘化亚铜转化为对I3-吸附能力弱的CuSCN;

【题目】碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
![]()
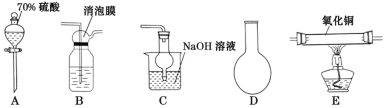
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____(填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
序号 | 实验 | 操作 | 现象 |
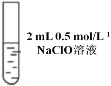
Ⅰ |
| 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
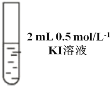
Ⅱ |
| 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2 在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因: __________(用离子方程式表示)。
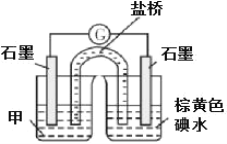
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________。
③小组同学又设计了如下实验:
序号 | 实验 | 操作 | 现象 |
Ⅳ |
| 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因 _____________。