题目内容
【题目】PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常广泛。
(1)PSCl3(结构式为: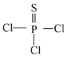 )中磷的化合价为______。
)中磷的化合价为______。
(2)S2Cl2分子中各原子均满足8电子结构,画出S2Cl2的结构式:_____。
(3)能说明同周期的相邻元素S的非金属性比Cl弱的事实是_____(填标号)。
A.H2SO3的酸性比HClO3的弱
B.气态H2S的热稳定性比HCl的弱
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓
D.SO2是常见的还原剂,ClO2是常见的氧化剂
(4)SOCl2(沸点78.8℃)可用作锂电池的非水电解质及有机合成的氯化剂等。
①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,该反应的化学方程式为_____。
②Li/SOCl2电池的电池反应为:4Li+2SOCl2→4LiCl↓+S+SO2。电池工作时,下列说法正确的是____(填标号)。
A.Li电极的质量不变 B.电能转变为化学能
C.负极发生氧化反应 D.正极上SOCl2被还原
【答案】+5 Cl-S-S-Cl BC S2Cl2+2SO2+3Cl2![]() 4SOCl2 CD
4SOCl2 CD
【解析】
(1)PSCl3中,结合结构式( )可知硫为-2价,氯为-1价,则磷的化合价为+5价;
)可知硫为-2价,氯为-1价,则磷的化合价为+5价;
(2)S2Cl2分子中各原子均满足8电子结构,故S2Cl2的结构式为Cl-S-S-Cl;
(3)A.通过含氧酸的酸性强弱来判断元素的非金属性强弱,一定要注意是用最高价的含氧酸,H2SO3和HClO3均不是最高价含氧酸,选项A错误;
B.元素的非金属性越强,对应氢化物就越稳定,气态H2S的热稳定性比HCl的弱,故Cl比S的非金属性强,选项B正确;
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓,说明氯气的氧化性强于硫,非金属单质氧化性越强,元素非金属性越强,选项C正确;
D.SO2、ClO2均不是最高价氧化物,不能根据它们的氧化性、还原性判断它们的非金属性强弱,选项D错误。
答案选BC;
(4)①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,反应的化学方程式为S2Cl2+2SO2+3Cl2![]() 4SOCl2;
4SOCl2;
②A.Li电极上生成LiCl,质量增加,选项A错误;
B.原电池是将化学能转为电能的装置,选项B错误;
C.原电池中负极发生失电子的氧化反应,选项C正确;
D.正极上SOCl2得电子被还原,选项D正确。
答案选CD。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。







