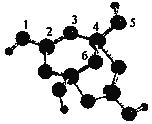
题目内容
【题目】Ⅰ.下列各组粒子,属于同种核素的是___________(填编号,下同),互为同位素的是___________,互为同素异形体的是___________,互为同分异构体的是___________,属于同种物质的是_____________,互为同系物的是__________。
①16O2和18O3 ② CH4 和C3H8 ③ H、D、T④ 3015R和 (核内15个中子)⑤CH3CH2OH和CH3OCH3⑥
(核内15个中子)⑤CH3CH2OH和CH3OCH3⑥ 和
和
Ⅱ.能源是现代社会发展的支柱之一。
⑴化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
A.Ba(OH)2·8H2O与NH4Cl混合搅拌 B.高温煅烧石灰石
C.铝与盐酸反应 D.C+H2O(g)=CO+ H2
②拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要吸收的能量
为a kJ,b kJ,c kJ,则1molN2和H2完全反应生成2mol NH3需要放出的热量为____________kJ。
⑵电能是现代社会应用最广泛的能源之一。

如下图所示的原电池装置中,负极是_______,正极上能够观察到的现象是_______________________,正极的电极反应式是_____________________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体________g。
【答案】④ ③ ① ⑤ ⑥ ② C (6b﹣3a﹣c) Zn 铜片表面产生无色气泡 2H++2e-=H2↑ 0.2
【解析】
Ⅰ.核素是指具有一定数目质子和一定数目中子的一种原子;具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;具有相同分子式而结构不同的化合物互为同分异构体;同素异形体是同种元素形成的不同单质;分子式相同、结构也相同的物质属于同种物质;结构相似、分子组成相差若干个CH2原子团的有机物互为同系物;
Ⅱ.⑴常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
②成键放出的总能量-断键吸收的总能量=反应放出的能量;
⑵原电池中,活泼电极为负极;正极上氢离子得电子生成氢气;负极是锌失电子生成锌离子;根据原电池总反应方程式计算生成氢气的质量。
Ⅰ.①16O2和18O3 是同种元素形成的不同单质,互为同素异形体;②CH4 和C3H8结构相似、分子组成相差2个CH2原子团,属于同系物;③![]() 是具有相同质子数、不同中子数的同一元素的不同原子,互为同位素;④
是具有相同质子数、不同中子数的同一元素的不同原子,互为同位素;④![]() 和
和 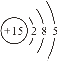 (核内15个中子)质子数和中子数都相同,属于同种核素;⑤CH3CH2OH和CH3OCH3是具有相同分子式,结构不同的化合物,互为同分异构体;⑥
(核内15个中子)质子数和中子数都相同,属于同种核素;⑤CH3CH2OH和CH3OCH3是具有相同分子式,结构不同的化合物,互为同分异构体;⑥ 分子式相同,结构相同,属于同种物质。故属于同种核素的是④,互为同位素的是③,互为同素异形体的是①,互为同分异构体的是⑤,属于同种物质的是⑥,互为同系物的是②。
分子式相同,结构相同,属于同种物质。故属于同种核素的是④,互为同位素的是③,互为同素异形体的是①,互为同分异构体的是⑤,属于同种物质的是⑥,互为同系物的是②。
Ⅱ.⑴A.Ba(OH)28H2O与NH4Cl混合搅拌是吸热反应,故不选A;
B.高温煅烧石灰石是吸热反应,故不选B;
C.铝与盐酸反应是放热反应,故选C;
D、C或氢气做还原剂时的反应是吸热反应,C+H2O(g)=CO+ H2是吸热反应,故不选D。
②![]()
![]()
![]() 生成2mol NH3吸收热量1mol×ckJ/mol+akJ/mol×3mol,放出热量bkJ/mol×3×2mol,放出6b﹣(3a+c)kJ=(6b﹣3a﹣c) kJ。
生成2mol NH3吸收热量1mol×ckJ/mol+akJ/mol×3mol,放出热量bkJ/mol×3×2mol,放出6b﹣(3a+c)kJ=(6b﹣3a﹣c) kJ。
⑵原电池中,活泼电极为负极,锌的活泼性大于铜,所以负极是Zn;正极上氢离子得电子生成氢气,正极反应式是2H++2e-=H2↑,现象是铜片表面产生无色气泡;负极是锌失电子生成锌离子;
原电池总反应为Zn+2H+= Zn2++H2↑,设生成氢气的质量为xg。
Zn+2H+= Zn2++H2↑
65 2
6.5 xg
![]()
X=0.2g。

【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4g)(无色),如图所示.
N2O4g)(无色),如图所示.
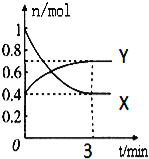
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正) ,v(逆) .(填“加快”或“减慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(Ls),乙中v(N2O4)=6mol/(Lmin),则 中反应更快.
(4)在0到3min中内N2O4的反应速率为 .
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A.v(NO2)=2v(N2O4) |
B.容器内压强不再发生变化 |
C.X的体积分数不再发生变化 |
D.容器内气体原子总数不再发生变化 |
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.