题目内容
【题目】已知:①从石油中获得是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

回答下列问题:
(1)写出A的结构简式:___。
(2)B、D分子中的官能团名称分别是___、___。
(3)写出下列反应的反应类型:①___,②___,④___。
(4)写出下列反应的化学方程式:
①___。
②___。
④___。
【答案】CH2=CH2 羟基 羧基 加成反应 氧化反应 酯化反应(或取代反应) CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】
根据该流程图B与D反应生成乙酸乙酯酯,可得B是乙醇,C是乙醛,D是乙酸;A是从石油中获得,且A的产量通常用来衡量一个国家的石油化工发展水平,则A是乙烯。
(1)A是乙烯,结构简式为CH2=CH2;
(2)B是乙醇,D是乙酸,分子中的官能团名称分别是羟基、羧基;
(3)反应①是乙烯和水加成生成乙醇;反应②是乙醇氧化生成乙醛;反应④是酸和醇发生酯化反应生成酯,属于取代反应;
(4)反应①是乙烯和水加成生成乙醇:CH2=CH2+H2O![]() CH3CH2OH;反应②是乙醇氧化生成乙醛:2CH3CH2OH+O2
CH3CH2OH;反应②是乙醇氧化生成乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应④是乙酸和乙醇发生酯化反应生成乙酸乙酯:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;反应④是乙酸和乙醇发生酯化反应生成乙酸乙酯:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。

【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。
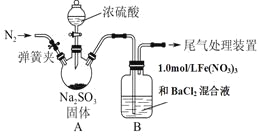
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |