题目内容
【题目】2.3g钠跟水反应后,得到100mL溶液,2Na+2H2O=2NaOH+H2↑
试计算:(1)生成的气体在标况下的体积是多少?___
(2)反应后所得溶液的物质的量浓度是多少?___
(3)在完全反应后转移的电子个数为多少?(用单线桥方法标出)___
【答案】1.12L 1mol/L 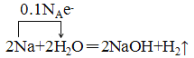
【解析】
n(Na)=![]() =0.1mol;
=0.1mol;
(1)该反应中Na失电子生成钠离子、水得电子生成氢气,根据转移电子守恒计算生成氢气体积;
(2)根据Na原子守恒得n(NaOH),再根据c=![]() 计算氢氧化钠物质的量浓度;
计算氢氧化钠物质的量浓度;
(3)根据反应中电子的转移数目和方向分析。
n(Na)=![]() =0.1mol;
=0.1mol;
(1)该反应中Na失电子生成钠离子、水得电子生成氢气,根据转移电子守恒得氢气体积=![]() ×22.4L/mol=1.12L;
×22.4L/mol=1.12L;
(2)根据Na原子守恒得n(NaOH)=n(Na)=0.1mol,c(NaOH)=
![]() =
=![]() =1mol/L;
=1mol/L;
(3)在反应2Na+2H2O=2NaOH+H2↑中Na从0价升高为+1价,则0.1molNa共失去0.1NA个电子,用单线桥表示反应中电子的转移数目和方向为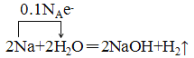 。
。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目