��Ŀ����
����Ŀ��̼���仯����㷺��������Ȼ�硣��ش��������⣺
��1����CO2��NH3Ϊԭ�Ͽɺϳ�����[CO(NH2)2]����֪��
��2NH3(g) �� CO2(g) === NH2COONH4(s) ��H��-159.47 kJ��mol-1
��NH2COONH4(s) === CO(NH2)2(s) �� H2O(g) ��H��+116.49 kJ��mol-1
��H2O(l) === H2O(g) ��H��+88.0 kJ��mol-1
д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ_____________��
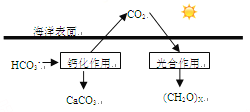
��2�������ǵ�����̼Ԫ�ص�������ճء���
�����ں�ˮ�е�CO2��Ҫ��������̼��ʽ���ڣ�����CO2��H2CO3��___________��_________��
���ں���̼ѭ���У���ͨ����ͼ��ʾ��;����̼��д���ƻ����õ����ӷ���ʽ_____________��
��3�����³�ѹ�£������е�CO2����ˮ�дﵽƽ��ʱ����ת����ϵ���£�
��CO2 + H2O![]() H2CO3 K=1.8��10-3
H2CO3 K=1.8��10-3
��H2CO3![]() H++HCO3- K a 1=4.3��10-7��
H++HCO3- K a 1=4.3��10-7��
��HCO3-![]() H++CO32- K a2=5.6��10-11��
H++CO32- K a2=5.6��10-11��
ͨ������£���ˮ��pHԼΪ8��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬����Һ��c(CO2)=____ mol/L����������λ��Ч���֣�
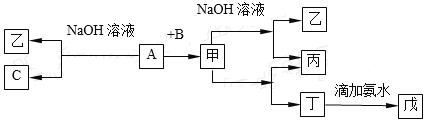
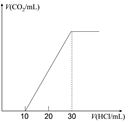
��4��Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ���� N2����CO2������NaOH��Һ���ա���1.0mol/L����ζ�����Һ�����ɵ�V(CO2)��V(����) �仯��ϵ����ͼ��ʾ��������Һ������Ũ���ɴ�С��˳��Ϊ______����ˮ����̼��Ũ��Ϊ___mol/L��
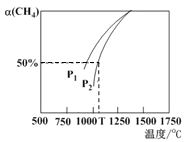
��5����CO2����Ȼ�������Ʊ�CO��H2��CO2(g) +CH4(g) ![]() 2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0. 1 mol/L��CH4��CO2����һ�������·�Ӧ�����CH4 ��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ��ʾ����ѹǿP1 ____P2���>����<��������P2= 3MPa����T��Cʱ�÷�Ӧ��ƽ�ⳣ�� Kp =_____MPa2
2CO(g)+2H2(g)���ܱ�������Ũ�Ⱦ�Ϊ0. 1 mol/L��CH4��CO2����һ�������·�Ӧ�����CH4 ��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ��ʾ����ѹǿP1 ____P2���>����<��������P2= 3MPa����T��Cʱ�÷�Ӧ��ƽ�ⳣ�� Kp =_____MPa2
����ƽ���ѹ����ƽ��Ũ�ȼ��㣬 ��ѹ=��ѹ������������������
���𰸡� 2NH3(g)+CO2=CO(NH2)(s)+H2O(l) ��H=-130.98kJ/mol HCO3- CO32- Ca2++2HCO3-=CaCO3��+CO2��+H2O 1.3��10-7mol/L c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) 0.2 < 4
����������1�����⿼���Ȼ�ѧ��Ӧ����ʽ�ļ��㣬�٣��ڣ��۵õ�2NH3(g)+CO2=CO(NH2)(s)+H2O(l) ��H=(��159.47��116.49��88)kJ��mol��1=��130.98kJ��mol��1����2���ٱ��⿼��������ʵĵ��룬H2CO3�Ƕ�Ԫ���ᣬ��ˮ�з������룬��H2CO3![]() HCO3����H����HCO3����H2O
HCO3����H����HCO3����H2O![]() CO32����H������˻����е�̼Ԫ�ص���ʽΪHCO3����CO32�����ڸ���Ϊʾ��ͼ���μӷ�Ӧ��������Ca2����HCO3������������CaCO3��CO2��������ӷ���ʽΪCa2����2HCO3��=CaCO3����CO2����H2O����3�����⿼��ƽ�ⳣ���ļ��㣬����ˮ�ĵ����HCO3���ĵ��룬pH=8�������Һ��c(H��)=10��8mol��L��1�����ݢ���Һ��c(HCO3��)=c(H��)10��8������Ka1=c(H��)��c(HCO3��)/c(H2CO3)��������ֵ���õ�c(H2CO3)=10��16/4.3��10��7mol��L��1������K=c(H2CO3)/c(CO2)��������ֵ��c(CO2)=10��16/(4.3��10��7��1.8��10��3)mol��L��1=1.3��10��7mol��L��1����4�����⿼������Ũ�ȵĴ�С�Ƚ��Լ������غ㣬����V(CO2)��V(HCl)�Ĺ�ϵͼ���Ƴ���Ӧ����Һ������ΪNaHCO3��Na2CO3�����������ʵ�����ȣ����CO32����ˮ��̶ȴ���HCO3�����������Ũ�ȴ�С˳����c(Na��)>c(HCO3��)>c(CO32��)>c(OH��)>c(H��)������30mL���ᣬ����ﵽ�����ʱ������ΪNaCl��n(Na��)=n(NaCl)=n(HCl)=30��10��3��1mol=3��10��2mol�����n(Na2CO3)=0.01mol��n(NaHCO3)=0.01mol����̼Ԫ���غ㣬��̼��Ũ��Ϊ(0.01��0.01)/100��10��3)mol��L��1=0.2mol��L��1����5��������������ԭ�����Լ�ƽ�ⳣ���ļ��㣬����ѹǿƽ�����淴Ӧ�����ƶ����������ת���ʽ��ͣ���P2>P1��CO2(g) +CH4(g)
CO32����H������˻����е�̼Ԫ�ص���ʽΪHCO3����CO32�����ڸ���Ϊʾ��ͼ���μӷ�Ӧ��������Ca2����HCO3������������CaCO3��CO2��������ӷ���ʽΪCa2����2HCO3��=CaCO3����CO2����H2O����3�����⿼��ƽ�ⳣ���ļ��㣬����ˮ�ĵ����HCO3���ĵ��룬pH=8�������Һ��c(H��)=10��8mol��L��1�����ݢ���Һ��c(HCO3��)=c(H��)10��8������Ka1=c(H��)��c(HCO3��)/c(H2CO3)��������ֵ���õ�c(H2CO3)=10��16/4.3��10��7mol��L��1������K=c(H2CO3)/c(CO2)��������ֵ��c(CO2)=10��16/(4.3��10��7��1.8��10��3)mol��L��1=1.3��10��7mol��L��1����4�����⿼������Ũ�ȵĴ�С�Ƚ��Լ������غ㣬����V(CO2)��V(HCl)�Ĺ�ϵͼ���Ƴ���Ӧ����Һ������ΪNaHCO3��Na2CO3�����������ʵ�����ȣ����CO32����ˮ��̶ȴ���HCO3�����������Ũ�ȴ�С˳����c(Na��)>c(HCO3��)>c(CO32��)>c(OH��)>c(H��)������30mL���ᣬ����ﵽ�����ʱ������ΪNaCl��n(Na��)=n(NaCl)=n(HCl)=30��10��3��1mol=3��10��2mol�����n(Na2CO3)=0.01mol��n(NaHCO3)=0.01mol����̼Ԫ���غ㣬��̼��Ũ��Ϊ(0.01��0.01)/100��10��3)mol��L��1=0.2mol��L��1����5��������������ԭ�����Լ�ƽ�ⳣ���ļ��㣬����ѹǿƽ�����淴Ӧ�����ƶ����������ת���ʽ��ͣ���P2>P1��CO2(g) +CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
��ʼ�� 0.1 0.1 0 0
�仯�� 0.05 0.05 0.1 0.1
ƽ�⣺ 0.05 0.05 0.1 0.1 H2�����ʵ�������Ϊ0.1/0.3=1/3��CO�����ʵ�������Ϊ1/3��CH4��CO2�����ʵ�������Ϊ0.05/0.3=0.5/3��Kp= 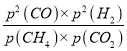 =
= 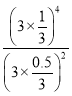 =4��
=4��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�