题目内容
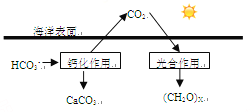
【题目】由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系。A是在地壳中含量最多的金属元素。请回答:
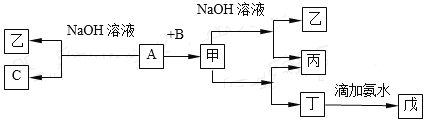
(1)物质的化学式为:乙_______,丁_______,戊________;
(2)甲物质在工业上的一种重要用途:_________________;
(3)A在元素周期表中的位置:__________________________;
(4)A→乙+C反应的化学方程式___________________________。
【答案】 NaAlO2 AlCl3 Al(OH)3 冶炼金属铝 第三周期IIIA族 2Al+2NaOH+2H2O === 2NaAlO2+3H2
【解析】A是地壳中含量最多的金属元素,则A为Al,Al与NaOH溶液反应生成单质C及乙,则C为H2,乙为NaAlO2.Al与单质B化合生成甲,甲能与氢氧化钠溶液、盐酸反应,则甲为Al2O3,B为O2,结合转化关系可知,丙为H2O,丁为AlCl3,丁与氨水反应生成戊为Al(OH)3;
(1)由上述分析可知,乙、丁、戊分别为NaAlO2、AlCl3、Al(OH)3;
(2)甲为Al2O3,含金属元素Al,且熔点较高,则可冶炼金属铝的原料或做耐火材料(坩埚等);
(3)Al元素处于周期表中第三周期ⅢA;
(4)A→乙+C反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
【题目】下列实验装置设计与对应结论正确的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 能证明Al(OH)3不溶于氨水 | 能证明非金属性:Cl>C>Si | 验证铁发生析氢腐蚀 | 洗气瓶中产生的白色沉淀是BaSO3 |
A. A B. B C. C D. D