题目内容
9.某有机化合物A的相对分子质量(分子量)大于100,小于110.经分析得知,其中C和H的质量分数之和为53.8%,其余为氧.请回答:(1)1个A分子中含有3个氧原子.
(2)已知A分子中C、H原子个数比=1:2,则该化合物的质谱图中最大质荷比为104.
(3)已知A可与碳酸钠溶液反应生成二氧化碳,A的核磁共振氢谱为3组峰,且面积比为6:1:1,则A的结构简式为
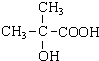 .
.
分析 (1)根据A分子中碳、氢元素的质量分数计算出氧元素的质量分数,然后根据A的相对分子质量范围确定分子中O原子取值范围,进而确定O原子数目;
(2)根据氧原子数目及氧元素质量分数确定A的相对分子质量,该化合物的质谱图中最大质荷比为其相对分子质量;
(3)A分子中C、H原子个数比=1:2,可设A的分子式为(CH2)nOx,x由(1)计算得到,根据A的相对分子质量计算出n的值,确定A的分子式,A可与碳酸钠溶液反应生成二氧化碳,说明A分子中含有羧基,结合A的核磁共振氢谱为3组峰且面积比为6:1:1确定其结构简式.
解答 解:(1)A分子中C和H的质量分数之和为53.8%,则氧元素的质量分数为:1-53.8%=46.2%,当相对分子质量为110时,A中最多含有氧原子个数为:$\frac{110×46.2%}{16}$≈3.2,当相对分子质量为100时,最少含有氧原子数目为:$\frac{100×46.2%}{16}$≈2.9,所以A中含有氧原子数为3,
故答案为:3;
(2)A的相对分子量为:$\frac{16×3}{46.2%}$≈104,该化合物的质谱图中最大质荷比为104,
故答案为:104;
(3)A分子中C、H原子个数比=1:2,可设A的分子式为:(CH2)nO3,则14n+16×3=104,解得:n=4,所以A的分子式为:C4H8O3,A可与碳酸钠溶液反应生成二氧化碳,说明A分子中含有羧基,由于A的分子式的不饱和度为2,则除了羧基外其它结构都为单键,A的核磁共振氢谱为3组峰,且面积比为6:1:1,则A中含有3种H原子,A中应该含有两个甲基,则A的结构简式为: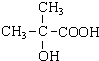 ,
,
故答案为: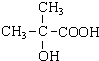 .
.
点评 本题考查有机物分子式与结构式的确定,题目难度不大,关键是计算确定A分子中氧原子数目.

练习册系列答案
相关题目
19. 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
 高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中,0价氧与-2价氧的数目比为2:1 |
20.针对下面几种元素,完成以下各小题.
(1)C、N、O、Si四种元素电负性从小到大排列?硅<碳<氮<氧(填名称).
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为? ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为? .
.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为?
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为?
 .
.
17.下列各主族元素的氢化物的沸点变化规律依次升高的是( )
| A. | HF、HCl、HBr、HI | B. | H2O、H2S、H2Se、H2Te | ||
| C. | NH3、PH3、AsH3、SbH3 | D. | CH4、SiH4、GeH4、SnH4 |
18.以下列分子式所表示的物质一定是纯净物的是( )
| A. | C2H5Cl | B. | C4H8 | C. | C6H6 | D. | C3H6O |
 如图所示装置
如图所示装置  如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题: