题目内容
19.A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子两倍,C燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:(1)元素符号:AC BO CNa DS
(2)写出C的单质在高温下与B的单质的反应方程式2Na+O2$\frac{\underline{\;高温\;}}{\;}$Na2O2;
(3)把B、C、D的原子半径大小按顺序排列:Na>S>O;
(4)B2D属于共价化合物(填“离子”或“共价”).
分析 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,所以A是C元素;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以C是Na元素,B是O元素,D是S元素,由此分析解答.
解答 解:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,所以A是C元素;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以C是Na元素,B是O元素,D是S元素.
(1)通过以上分析知,A是C,B是O,C是Na,D是S,故答案为:C;O;Na;S;
(2)钠在高温条件下和氧气反应生成过氧化钠,反应方程式为2Na+O2$\frac{\underline{\;高温\;}}{\;}$Na2O2,故答案为:2Na+O2$\frac{\underline{\;高温\;}}{\;}$Na2O2;
(3)电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,所以原子半径大小顺序排列为:Na>S>O,故答案为:Na>S>O;
(4)B2D是二氧化硫,是共价化合物,故答案为:共价.
点评 本题以元素的推断为载体考查了元素化合物的性质,难度不大,能正确推断元素是解本题的关键,明确微粒半径大小的比较方法.

练习册系列答案
相关题目
7.已知R-X+2Na+R′-X→R-R′+2NaX,若用CH3CH2Br和 (CH3)2CHBr 的混合物与金属钠反应,生成的烷烃不可能是( )
| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | CH3CH2CH(CH3)2 |
14. 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙与庚的原子核外电子数相差14 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
4.漂白粉的有效成分是( )
| A. | Ca(ClO)2 | B. | CaCl2 | C. | NaOH | D. | NaClO |
11.已知Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),化工生产中常用MnS(s)作沉淀剂去除废水中的Cu2+.下列有关说法正确的是( )
| A. | 当c(Cu2+)=c(Mn2+)时该反应达到平衡 | |
| B. | 从该反应原理可以得出CuS的溶解度比MnS的溶解度大 | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ | |
| D. | 往平衡体系中加入少量CuSO4(s)后,c( Mn2+)不变 |
16.下列表示的是有机化合物结构式中的一部分,其中不是官能团的是( )
| A. | -OH | B. | -C≡C- | C. |  | D. | C-C |
17.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”.下列有关“四中子”粒子的说法不正确的是( )
| A. | 该粒子不显电性 | B. | 该粒子质量数为4 | ||
| C. | 与氢元素的质子数相同 | D. | 该粒子质量比氢原子大 |
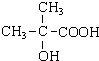 .
.