题目内容
17.下列各主族元素的氢化物的沸点变化规律依次升高的是( )| A. | HF、HCl、HBr、HI | B. | H2O、H2S、H2Se、H2Te | ||
| C. | NH3、PH3、AsH3、SbH3 | D. | CH4、SiH4、GeH4、SnH4 |
分析 氢化物都是分子晶体,其熔沸点与相对分子质量成正比,但含有氢键的氢化物熔沸点较高,据此分析解答.
解答 解:氢化物都是分子晶体,其熔沸点与相对分子质量成正比,但含有氢键的氢化物熔沸点较高,
A.HF中含有氢键,所以熔沸点最高,则卤族元素氢化物熔沸点依次升高顺序是HCl<HBr<HI<HF,故A错误;
B.水中含有氢键,所以熔沸点最高,则氧族元素氢化物熔沸点依次升高顺序是H2S、H2Se、H2Te、H2O,故B错误;
C.氨气中含有氢键,所以熔沸点最高,则氮族元素氢化物熔沸点依次升高顺序是PH3、AsH3、SbH3、NH3,故C错误;
D.碳族元素氢化物中都不含氢键,所以其熔沸点与其相对分子质量成正比,则熔沸点依次升高的顺序是CH4、SiH4、GeH4、SnH4,故D正确;
故选D.
点评 本题考查物质熔沸点高低判断,明确熔沸点高低影响因素是解本题关键,注意所有物质中熔沸点与晶体类型有关,分子晶体中与相对分子质量及氢键有关,知道常见含有氢键的氢化物,题目难度不大.

练习册系列答案
相关题目
7.一氯取代物的同分异构体有2种,二氯取代物的同分异构体有4种的烷烃是( )
| A. | 丙烷 | B. | 乙烷 | C. | 正丁烷 | D. | 正戊烷 |
8.在铁制品上镀上一定厚度的铜层,以下设计方案正确的是( )
| A. | 铜作阳极,镀件作阴极,溶液中含有铜离子 | |
| B. | 铁作阴极,镀件作阳极,溶液中含有铜离子 | |
| C. | 铁作阳极,镀件作阴极,溶液中含有亚铁离子 | |
| D. | 铜用阴极,镀件作阳极,溶液中含有锌离子 |
5.0.1mol•L-1 AgNO3溶液在以Ag作阳极、Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是( )
| A. | 溶液的浓度变为0.08 mol•L-1 | B. | 阳极上产生112 mL O2(标准状况) | ||
| C. | 转移的电子数是1.204×1022 | D. | 反应中有0.02 mol的Ag被氧化 |
2.己烯是乙烯的同系物,常温下是无色的液体,难溶于水,比水轻.鉴别己烯、苯、四氯化碳三种无色液体,可选用的一种试剂是( )
| A. | 盐酸 | B. | 食盐水 | C. | 酒精 | D. | 溴水 |
6.下列说法正确的是( )
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,所以非金属性C>Si | |
| B. | 由Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Na2SiO3可知硅酸的酸性大于碳酸 | |
| C. | 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 | |
| D. | 由H2S+CuSO4═CuS↓+H2SO4可知,氢硫酸的酸性比硫酸强 |
7.已知R-X+2Na+R′-X→R-R′+2NaX,若用CH3CH2Br和 (CH3)2CHBr 的混合物与金属钠反应,生成的烷烃不可能是( )
| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | CH3CH2CH(CH3)2 |
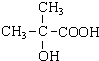 .
.