��Ŀ����
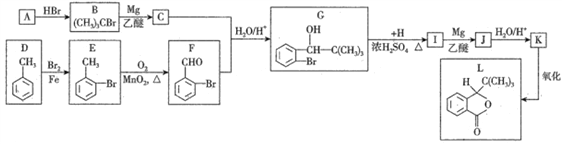
����Ŀ��(1)Ϊ������������(NOx)����Ⱦ���ɲ��ü������ԭ��:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
���H2=_________��
(2)�״���������Ƶ���Ҫ�Ļ�����Ʒ������ȩ���Ʊ�������������ת����ϵ��ͼ��ʾ��

��д��������Ӧ���Ȼ�ѧ����ʽ______________��
�ڷ�Ӧ�ȴ�С�Ƚ�:����I______����II������ڡ�����С�ڡ����ڡ�����
��������Ӧ������,������ϵ��ͨ��������������������������ϵ�е�H2�������ȩ���ʣ�ͬʱʹ��Ӧ�¶ȱ��ֲ��䣬��������n(CH3OH)��n(����)=________������֪:H2(g)+![]() O2(g)==H2O(g) ��H=-akJ/mol��������O2���������Ϊ0.2)
O2(g)==H2O(g) ��H=-akJ/mol��������O2���������Ϊ0.2)
(3)��ҵ�ϳ���CO��CO2��H2�ϳɼ״�ȼ�ϣ���ԭ��Ϊ:
��CO(g)+2H2(g)![]() CH3OH(g) ��H<0
CH3OH(g) ��H<0
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H>0
CO(g)+H2O(g) ��H>0
������������ɹ̶�ʱ��COƽ��ת����(��)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��ͼ�е�ѹǿ�ɴ�С˳��Ϊ_____���ж�������_____________���Խ���COƽ��ת�������¶��������С��ԭ����__________________��

���𰸡� -1160kJ/mol CH3OH(g)==HCHO(g)+H2(g) ��H=+(E2-E1)kJ/mol ���� ![]() P1>P2>P3 ��ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת�������� �����¶�ʱ����Ӧ��Ϊ���ȷ�Ӧ��ƽ���������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO���������ܽ�������¶����ߣ�ʹCO��ת���ʽ���
P1>P2>P3 ��ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת�������� �����¶�ʱ����Ӧ��Ϊ���ȷ�Ӧ��ƽ���������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO���������ܽ�������¶����ߣ�ʹCO��ת���ʽ���
��������(1)��֪����CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1=-574kJ/mol
![]() CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
���ݸ�˹���ɣ��ɢۡ�2-�ٵ÷�ӦCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)���H2=��H3��2-��H1=-867kJ/mol��2-��-574kJ/mol��= -1160kJ/mol��
��2���ٸ���ͼ����Ϣ��֪��������Ӧ���Ȼ�ѧ����ʽΪ��CH3OH(g)==HCHO(g)+H2(g) ��H=+(E2-E1)kJ/mol���ڴ����ı仯ѧ��Ӧ�Ļ�ܣ������ܸı䷴Ӧ���ʱ䣬�ʷ�Ӧ�ȴ�С�Ƚ�:����I���ڹ���II��
�� CH3OH(g)===HCHO(g)��H2(g) ��H��+(E2��E1) kJ/mol
1 mol (E2��E1) kJ
n(CH3OH) mol n(CH3OH)(E2��E1) kJ
H2(g)��![]() O2(g)===H2O(g) ��H����a kJ/mol
O2(g)===H2O(g) ��H����a kJ/mol
0��5 mol a kJ
n(O2) mol 2an(O2) kJ
��n(CH3OH)(E2��E1)��2an(O2)����n(CH3OH)��n(O2)��![]() ��
��
��n(CH3OH)��n(����)��![]() ��
��
��3����ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת�������ߣ�����ͼ�е�ѹǿ�ɴ�СΪP1��P2��P3����Ӧ��Ϊ���ȷ�Ӧ�������¶�ʱ��ƽ�������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO�����������ս�������¶����ߣ�ʹCO��ת���ʽ��͡�