题目内容
工业上制取纯净的CuCl2·2H2O的主要过程是:①将粗氧化铜(含少量Fe)溶解于稀盐酸中。加热、过滤,调节滤液的pH为3;②对①所得滤液按下列步骤进行操作:
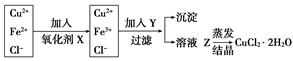
已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解而沉淀,请回答以下问题:
(1)X是________,其反应的离子方程式是___________________________________。
(2)Y物质应具备的条件是_________________,生产中Y可选______________________。
(3)溶液Z在蒸发结晶时应注意__________________________________________。

已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解而沉淀,请回答以下问题:
(1)X是________,其反应的离子方程式是___________________________________。
(2)Y物质应具备的条件是_________________,生产中Y可选______________________。
(3)溶液Z在蒸发结晶时应注意__________________________________________。
(1)Cl2(H2O2) Cl2+2Fe2+===2Fe3++2Cl-
(2)调节溶液酸性,使pH为4~5,且不引进新杂质 CuO或Cu(OH)2或其它合理答案
(3)通入HCl气体(或加入盐酸),并不断搅拌且不能蒸干
(2)调节溶液酸性,使pH为4~5,且不引进新杂质 CuO或Cu(OH)2或其它合理答案
(3)通入HCl气体(或加入盐酸),并不断搅拌且不能蒸干
首先,从溶液中蒸发结晶CuCl2·2H2O,应当在酸性环境中,避免其水解。再有,为了分离铁及铜元素,根据Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解的特性,通过把Fe2+氧化为Fe3+,调节PH,除去Fe3+。当然在氧化Fe2+、调节pH时,加入试剂不能引入新的杂质。应以绿色氧化剂H2O2、铜的氧化物或氢氧化物为宜。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1  2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
 将植物桔杆、动物粪便等制成沼气以替代液化石油气符合“低碳经济”
将植物桔杆、动物粪便等制成沼气以替代液化石油气符合“低碳经济”