题目内容
(14分)碳酸锶广泛应用于电子工业。以天青石(主要成分为SrSO4)为基本原料制备碳酸锶。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s) 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1
SrSO4(s) + 2C(s) 2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1
则:反应C(s) + CO2(g)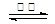 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s)
 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1 SrSO4(s) + 2C(s)
 2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1 则:反应C(s) + CO2(g)
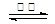 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
(1)①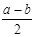 (2分) ②2SrS+2H2O
(2分) ②2SrS+2H2O Sr(OH)2+Sr(HS)2(3分)
Sr(OH)2+Sr(HS)2(3分)
③Sr(OH)2+NH4HCO3= SrCO3+H2O+NH3·H2O(3分)
(2)①SrSO4 + CO32- = SrCO3 + SO42- (3分) ②2.91(3分)
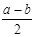 (2分) ②2SrS+2H2O
(2分) ②2SrS+2H2O Sr(OH)2+Sr(HS)2(3分)
Sr(OH)2+Sr(HS)2(3分)③Sr(OH)2+NH4HCO3= SrCO3+H2O+NH3·H2O(3分)
(2)①SrSO4 + CO32- = SrCO3 + SO42- (3分) ②2.91(3分)
(1)①考查盖斯定律的应用。将反应SrSO4(s) + 4C(s) 4CO(g) + SrS(s)和SrSO4(s) + 2C(s)
4CO(g) + SrS(s)和SrSO4(s) + 2C(s) 2CO2(g) + SrS(s)相减即得到2C(s) + 2CO2(g)
2CO2(g) + SrS(s)相减即得到2C(s) + 2CO2(g)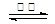 4CO(g),所以C(s) + CO2(g)
4CO(g),所以C(s) + CO2(g)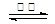 2CO(g)的△H=
2CO(g)的△H=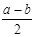 kJ·mol-1。
kJ·mol-1。
②强碱弱酸盐,水解显碱性,方程式为2SrS+2H2O Sr(OH)2+Sr(HS)2。
Sr(OH)2+Sr(HS)2。
③根据原子守恒可知,反应式为Sr(OH)2+NH4HCO3= SrCO3+H2O+NH3·H2O。
(2)①根据复分解反应的特点可知,方程式为SrSO4 + CO32- = SrCO3 + SO42- 。
②根据溶度积常数的表达式可知,c(CO32-)︰c(SO42-)=Ksp(SrCO3)︰Ksp(SrSO4),代入有关数据即可得到c(SO42-)=2.91mol/L。
 4CO(g) + SrS(s)和SrSO4(s) + 2C(s)
4CO(g) + SrS(s)和SrSO4(s) + 2C(s) 2CO2(g) + SrS(s)相减即得到2C(s) + 2CO2(g)
2CO2(g) + SrS(s)相减即得到2C(s) + 2CO2(g)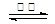 4CO(g),所以C(s) + CO2(g)
4CO(g),所以C(s) + CO2(g)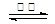 2CO(g)的△H=
2CO(g)的△H=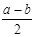 kJ·mol-1。
kJ·mol-1。②强碱弱酸盐,水解显碱性,方程式为2SrS+2H2O
 Sr(OH)2+Sr(HS)2。
Sr(OH)2+Sr(HS)2。③根据原子守恒可知,反应式为Sr(OH)2+NH4HCO3= SrCO3+H2O+NH3·H2O。
(2)①根据复分解反应的特点可知,方程式为SrSO4 + CO32- = SrCO3 + SO42- 。
②根据溶度积常数的表达式可知,c(CO32-)︰c(SO42-)=Ksp(SrCO3)︰Ksp(SrSO4),代入有关数据即可得到c(SO42-)=2.91mol/L。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
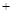 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 (Li2CO3)/g
(Li2CO3)/g


 2H2O
2H2O