��Ŀ����
����Ŀ�����ݵ绯ѧ֪ʶ�ش��������⣺
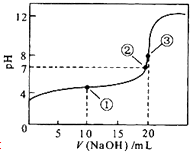
��1����ͼ��ʾ���ڲ�ͬ�ĵ������Һ�п�����ɲ�ͬ�ĵ�ء�

�ٵ��������ҺΪϡ����ʱ��Fe�缫��________(���������)��,��缫��ӦʽΪ__________��
�ڵ��������ҺΪNaOH��Һʱ��Al�缫��________(���������) ������缫��ӦʽΪ_________��
����������Ϊп���������ҺΪŨ���ᣬ��Fe�缫��______(���������)������缫��ӦʽΪ_______________________________��
��2����������ԭ���ԭ�������ʵ�飬�Ƚ�ͭ�����Ľ�����ԡ�����ʵ��װ��ͼ�������������������������________

���𰸡� �� 2H����2e��===H2�� �� Al��3e����4OH��===AlO![]() ��2H2O �� NO
��2H2O �� NO![]() ��2H����e��===NO2����H2O
��2H����e��===NO2����H2O 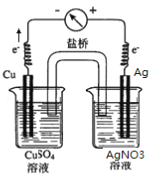
�������������������1�������Ļ����Դ����������������ҺΪϡ����ʱ�����Ǹ������������������������������Ʒ�Ӧ�����������ҺΪNaOH��Һʱ�����Ǹ���������������Ϊп���������ҺΪŨ���ᣬ����Ũ�����жۻ�������������(2)����ԭ���ԭ�����Ƚ�ͭ�����Ľ������ǿ����ͭ��ԭ��صĸ�����������������ͭ��������ͭ��Һ�У���������������Һ�У��õ������ӣ������ձ����������ӣ�������ͭ��������������
��������1�������Ļ����Դ����������������ҺΪϡ����ʱ�����Ǹ������������������������ӵõ��������������缫��Ӧʽ��2H����2e��===H2�������������������Ʒ�Ӧ�����������ҺΪNaOH��Һʱ�����Ǹ�����������ʧ��������AlO![]() ��������Ӧʽ��Al��3e����4OH��===AlO
��������Ӧʽ��Al��3e����4OH��===AlO![]() ��2H2O������������Ϊп���������ҺΪŨ���ᣬ����Ũ�����жۻ�����������������NO
��2H2O������������Ϊп���������ҺΪŨ���ᣬ����Ũ�����жۻ�����������������NO![]() �õ��ӷų�NO2������������Ӧʽ��NO
�õ��ӷų�NO2������������Ӧʽ��NO![]() ��2H����e��===NO2����H2O��(2)����ԭ���ԭ�����Ƚ�ͭ�����Ľ������ǿ����ͭ��ԭ��صĸ�����������������ͭ��������ͭ��Һ�У���������������Һ�У��õ������ӣ������ձ����������ӣ�������ͭ��������������װ��ͼΪ
��2H����e��===NO2����H2O��(2)����ԭ���ԭ�����Ƚ�ͭ�����Ľ������ǿ����ͭ��ԭ��صĸ�����������������ͭ��������ͭ��Һ�У���������������Һ�У��õ������ӣ������ձ����������ӣ�������ͭ��������������װ��ͼΪ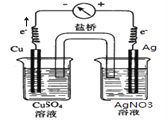 ��
��