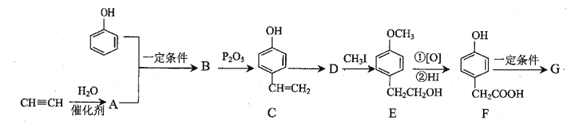
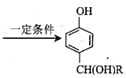
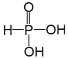
题目内容
【题目】A+、B+、C–、D、E五种粒子(分子和离子)中,每个粒子均有10个电子。已知:①A++C–=E+D②B++C–=2D
(1)C–离子的电子式是_________
(2)具有相同空间构型的粒子______和______,E分子的空间构型为_________,_______性分子。
(3)分别写出A+和D反应、B+和E反应的离子方程式_____________、_____________。
【答案】![]() NH3 H3O+ 三角锥形 极性 NH4+ + H2O
NH3 H3O+ 三角锥形 极性 NH4+ + H2O![]() NH3H2O + H+ NH3 + H3O+ = NH4+ + H2O
NH3H2O + H+ NH3 + H3O+ = NH4+ + H2O
【解析】
A+、B+、C–、D、E五种粒子(分子和离子)中,每个粒子均有10个电子。已知:①A++C–=E+D,则A为NH4+、C为OH-,E、D为NH3或H2O,根据②B++C-= 2D得出D为H2O,E为NH3,B为H3O+。
(1)OH-离子的电子式是![]() ,故答案为:
,故答案为:![]() 。
。
(2)具有相同空间构型的粒子NH3和H3O+,都为三角锥形,E分子的空间构型为三角锥形,空间不对称,为极性分子;故答案为:NH3;H3O+;三角锥形;极性。
(3) A+和D水解反应生成一水合氨和氢离子、B+和E反应生成铵根和水,其离子方程式分别为NH4+ + H2O![]() NH3H2O + H+,E、D为NH3 + H3O+ = NH4+ + H2O;故答案为:NH4+ + H2O
NH3H2O + H+,E、D为NH3 + H3O+ = NH4+ + H2O;故答案为:NH4+ + H2O![]() NH3H2O + H+;E、D为NH3 + H3O+ = NH4+ + H2O。
NH3H2O + H+;E、D为NH3 + H3O+ = NH4+ + H2O。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)CO2(g) + 2N2(g) + 2H2O ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
(2)用活性炭还原法可以消除NO 的污染,发生的反应为C(s)+2NO(g)N2(g)+CO2(g)。1molNO 和足量的活性炭在T℃、容积恒定为2L的密闭容器中反应,经过5min反应达到平衡,测得NO的物质的量为0.4mol。
①从反应开始到5min,用氮气表示的平均反应速率为_________。达到平衡后,向容器中再通入0.1molNO气体和0.3molCO2气体,则此平衡将_________(填“正向移动”“不移动”或“逆向移动”)。
②能判断该反应一定达到化学平衡状态的依据是_________(填标号)。
a.NO和N2的体积比保持不变
b.单位时间内生成2nmolNO的同时消耗nmolCO2
c.恒温恒容条件下,反应体系的压强不再发生改变
d.恒容条件下,混合气体的平均相对分子质量不变
(3)某实验小组模拟4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙(填“>、=、<或不确定”)
甲 | 乙 |
0.2molNO2 | 0.1molNO2 |
0.4molCO | 0.2molCO |