题目内容
3.下列离子方程式书写正确的是( )| A. | 铁和稀盐酸溶液反应 2Fe+6H+═2Fe2++6H2↑ | |
| B. | 醋酸和小苏打溶液反应 CH3COOH+HCO3-═CH3COO-+H2O+CO2↑ | |
| C. | 二氧化碳和少量烧碱溶液反应 CO2+2OH-═CO32-+H2O | |
| D. | 氯化亚铁和氯气反应生成氯化铁 Fe2++Cl2═Fe3++2Cl- |
分析 A.不符合客观事实;
B.二者反应生成醋酸钠和水、二氧化碳;
C.氢氧化钠少量,反应生成碳酸氢钠;
D.电荷不守恒.
解答 解:A.铁和稀盐酸溶液反应生成二价铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.醋酸和小苏打溶液反应,离子方程式:CH3COOH+HCO3-═CH3COO-+H2O+CO2↑,故B正确;
C.二氧化碳和少量烧碱溶液反应,离子方程式:CO2+OH-═HCO3-,故C错误;
D.氯化亚铁和氯气反应生成氯化铁,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.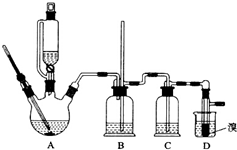 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH $→_{170℃}^{H_{2}SO_{4}(浓)}$ CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{H_{2}SO_{4}(浓)}$ CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
14.在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.下表是某同学配制的500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是A.
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.008 mol/L.
(3)配制上述“鲜花保鲜剂”所需的仪器有:电子天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、500ml容量瓶.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BCD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移后洗涤烧杯2-3次,并把洗涤液倒入容量瓶中
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
| 成分 | 蔗糖 | 硫酸钾 | 阿司匹林 | 高锰酸钾 | 硝酸银 |
| 质量(g) | 25.00 | 0.174 | 0.17 | 0.316 | 0.340 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.008 mol/L.
(3)配制上述“鲜花保鲜剂”所需的仪器有:电子天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、500ml容量瓶.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BCD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移后洗涤烧杯2-3次,并把洗涤液倒入容量瓶中
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
18.相同质量的H2SO4和H3PO4具有不同的( )
| A. | 分子数 | B. | 原子数 | C. | 电子数 | D. | 氧原子数 |
15.某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
(1)实验③发生的反应的离子方程式为Fe+Cu2+=Fe2++Cu.
(2)上述实验说明黑色粉末X中含有Fe3O4和Fe的混合物.
II.定量测定
根据如图所示的实验方案进行实验并记录数据:
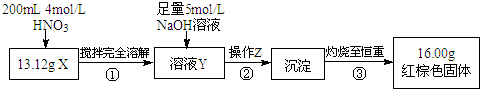
(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe:0.11mol、Fe3O4:0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(2)上述实验说明黑色粉末X中含有Fe3O4和Fe的混合物.
II.定量测定
根据如图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe:0.11mol、Fe3O4:0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管