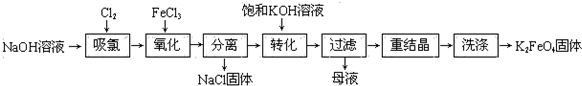
题目内容
5. 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.(1)反应到5min时,氢气反应速率1.2mol/(L•min).A的平衡常数为$\frac{16}{(a-2)(b-6){\;}^{3}}$(用含a,b的表达式表示)
(2)在10min时采取的措施是移走生成的氨气,降低氨气的浓度
(3)若合成塔内生成17g氨气放出45.5kJ热量,写出合成氨反应的热化学方程式N2(g)+3H2?2NH3(g)△H=-91KJ/mol
(4)反应达平衡后,再充入一定量的氮气和氢气,反应向正反应方向移动(填:“正反应方向”、“逆反应方向”)、平衡常数不变 (填“增大”、“减少”、“不变”)
分析 (1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,根据v=$\frac{△c}{△t}$计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
根据三段式计算平衡时各组分的浓度,代入平衡常数k=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$计算;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)若合成塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式;
(4)反应达平衡后,再充入一定量的氮气和氢气,增加反应物浓度平衡向正反应方向移动,平衡常数只受温度影响,当温度不变时,平衡常数不变;
解答 解:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,故v(NH3)=$\frac{4mol/L}{5min}$=0.8mol/(L•min),速率之比等于化学计量数之比,
故v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.8mol/(L•min)=1.2mol/(L•min),
N2+3H2?2NH3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$=$\frac{4{\;}^{2}}{(a-2)(b-6){\;}^{3}}$=$\frac{16}{(a-2)(b-6){\;}^{3}}$;
故答案为:1.2mol/(L•min);$\frac{16}{(a-2)(b-6){\;}^{3}}$;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)塔内生成17g氨气放出45.5kJ热量,34g氨气生成放热91KJ,标注物质聚集状态和对应反应焓变写出合成氨反应的热化学方程式为:N2(g)+3H2=2NH3(g)△H=-91KJ/mol;
故答案为:N2(g)+3H2?2NH3(g)△H=-91KJ/mol;
(4)反应达平衡后,再充入一定量的氮气和氢气,增加反应物浓度平衡向正反应方向移动,平衡常数只受温度影响,所以充入一定量的氮气和氢气,平衡常数不变,
故答案为:正反应方向; 不变;
点评 本题考查化学反应速率计算、平衡常数有关计算与影响因素、化学平衡图象与影响因素、等效平衡、反应热的有关计算等,题目综合性较大,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 纤维素从化学成分看,它是一种多糖.食物中的纤维素不仅能为人体提供能量,也能促进肠道蠕动、吸附排出有害物质 | |
| B. | 某物质的结构为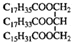 ,与其互为同分异构体,且完全水解后产物相同的油脂有3种 ,与其互为同分异构体,且完全水解后产物相同的油脂有3种 | |
| C. | 蛋白质的检验方法有许多种,而与双缩脲试剂作用而产生紫玫瑰色的颜色反应是最常见的方法之一 | |
| D. | 糖类、油脂、蛋白质是人类最主要的能量来源,它们都是天然高分子化合物 |
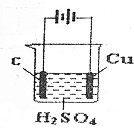
| A. | 这是一个电解池 | |
| B. | C作阴极,Cu作阳极 | |
| C. | 电解的过程实际上是电解水 | |
| D. | 石墨电极上的反应是4OH--4e-=O2↑+2H20 |
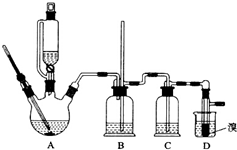 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{H_{2}SO_{4}(浓)}$ CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”);
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4s时c(B)为0.76mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
| 成分 | 蔗糖 | 硫酸钾 | 阿司匹林 | 高锰酸钾 | 硝酸银 |
| 质量(g) | 25.00 | 0.174 | 0.17 | 0.316 | 0.340 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为0.008 mol/L.
(3)配制上述“鲜花保鲜剂”所需的仪器有:电子天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、500ml容量瓶.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BCD.
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移后洗涤烧杯2-3次,并把洗涤液倒入容量瓶中
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
[探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(2)上述实验说明黑色粉末X中含有Fe3O4和Fe的混合物.
II.定量测定
根据如图所示的实验方案进行实验并记录数据:
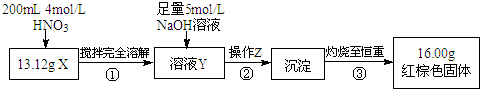
(1)操作Z的名称是过滤.
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为Fe:0.11mol、Fe3O4:0.03mol.
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=1mol/L.