题目内容
14.若要使2mol CH4完全和Cl2发生取代反应,且生成的四种氯代物的物质的量相同,则所需Cl2的物质的量为( )| A. | 5mol | B. | 4mol | C. | 3mol | D. | 2mol |
分析 根据四种取代物的物质的量相等结合碳原子守恒计算取代物的物质的量,再根据被取代的氢原子和氯气分子之间的关系式计算消耗氯气的物质的量.
解答 解:2mol甲烷完全与氯气发生取代反应,若生成相同物质的量的四种取代物,所以每种取代物的物质的量是0.5mol,甲烷和氯气的取代反应中,被取代的氢原子的物质的量与氯气的物质的量相等,
所以生成0.5mol一氯甲烷需要氯气0.5mol氯气,
生成0.5mol二氯甲烷需要氯气1mol,
生成0.5mol三氯甲烷需要氯气1.5mol氯气,
生成0.5mol四氯化碳需要氯气2mol,
所以总共消耗氯气的物质的量=0.5mol+1mol+1.5mol+2mol=5mol,
故选A.
点评 本题考查了甲烷的取代反应,明确甲烷的取代反应中被取代的氢原子和氯气之间的关系是解本题的关键,难度不大.

练习册系列答案
相关题目
5.可以验证硫元素的非金属性比氯元素弱的事实是( )
①S在常温下是固体单质,Cl2在常温下是气体
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁反应,其产物是FeS、FeCl3
④高氯酸(HClO4)的酸性比硫酸强
⑤气态氢化物的稳定性:H2S<HCl.
①S在常温下是固体单质,Cl2在常温下是气体
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁反应,其产物是FeS、FeCl3
④高氯酸(HClO4)的酸性比硫酸强
⑤气态氢化物的稳定性:H2S<HCl.
| A. | ①②④ | B. | ②④ | C. | ②③④⑤ | D. | ①③⑤ |
9.2010年以来我国严格抑制了稀土资源的开发和出口,从而引起了美国等西方国家的不满和恐慌.下列有关稀土资源${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
19.下列说法正确的是( )
| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是( )
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
3.下列说法不正确的是( )
| A. | 126C、136C、146C为碳元素的三种核素.元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,加快该反应的速率,却不能提高该反应的平衡转化率 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 绿色荧光蛋白在研究癌症发病机制的过程中应用突出,但其在酸性或碱性条件下可能会失去发光功能 |
4.已知下表数据:
对于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液,下列说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到的是红褐色沉淀 | |
| B. | 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 | |
| C. | 向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | |
| D. | 向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
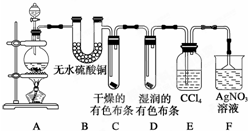 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.