题目内容
15.几种短周期元素的原子半径及主要化合价如表:| 元素 | X | Y | Z | W |
| 原子半径/pm | 186 | 143 | 75 | 71 |
| 主要化合价 | +1 | +3 | +5、+3、-3 | -1 |
| A. | X、Y元素的金属性X<Y | |
| B. | Z的气态氢化物比W的气态氢化物稳定 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 四种元素对应的简单离子的离子半径大小顺序为Z3->W->X+>Y3+ |
分析 W化合价为-1价,没有最高正化合价+7价,故W为F元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与F元素相差不大,则Z与F元素处于同一周期,则Z为N元素;X化合价为+1价,应为周期表第ⅠA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Na元素,Y为Al元素.结合元素周期律知识解答该题.
解答 解:W化合价为-1价,没有最高正化合价+7价,故W为F元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与F元素相差不大,则Z与F元素处于同一周期,则Z为N元素;X化合价为+1价,应为周期表第ⅠA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Na元素,Y为Al元素.
A.X、Y元素位于相同周期,同周期元素从左到右元素的金属性逐渐减弱,则金属性X>Y,故A错误;
B.非金属性W>Z,W的气态氢化物比Z的气态氢化物稳定,故B错误;
C.Y的最高价氧化物对应的水化物为氢氧化铝,不溶于弱碱,故C错误;
D.四种离子具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径大小顺序为Z3->W->X+>Y3+,故D正确.
故选D.
点评 本题考查元素位置结构和性质的关系及应用,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,题目难度中等.

练习册系列答案
相关题目
1.下列关于摩尔质量的说法正确的是( )
| A. | HNO3的摩尔质量是63g | |
| B. | 物质的摩尔质量越大,物质的质量越大 | |
| C. | 摩尔质量就等于该物质的相对分子质量 | |
| D. | 醋酸的摩尔质量在数值上与NA个醋酸分子的质量相等 |
6.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
Ⅰ.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.亚硫酸氢钠 C.生石灰 D.铁屑
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
Ⅱ.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
10.将一小块金属钠投入下列物质的溶液中,既能放出气体,又有沉淀析出的是( )
| A. | NH4Cl | B. | BaCl2 | C. | CuCl2 | D. | NaHCO3 |
20.难溶于水而且比水轻的含氧有机物是( )
①植物油
②乙酸
③乙酸乙酯.
①植物油
②乙酸
③乙酸乙酯.
| A. | ①②③ | B. | ①② | C. | ①③ | D. | ②③ |
7.下列操作或仪器选用不正确的是( )
| A. |  石油蒸馏 | B. |  检验Fe3+ | C. | 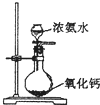 制备氨气 | D. |  中和滴定 |
4.不考虑水的电离,下列水溶液中的四种离子可以大量共存,且物质的量浓度也相等的是( )
| A. | Na+、K+、MnO4-、NO3- | B. | ClO-、I-、NH4+、Ba2+ | ||
| C. | Na+、AlO2-、K+、HCO3- | D. | Al3+、K+、SO42-、NO3- |
