题目内容
3.MnO2是常见的催化剂,MnCO3(s)热分解法是目前制备MnO2的常见方法.反应原理为2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)△H;该反应的过程为:①MnCO3(s)?MnO(s)+CO2(g)△H1;
②MnO(s)+O2(g)?2MnO2(s)△H2.
(1)△H,△H1,△H2三者之间关系为△H=2△H1+△H2,反应②在低温下能自发进行,则其△H<0(填“<”,“=”或“>”).
(2)300℃时,体系中各物质浓度随时间变化如图1所示.在0~60s时段,反应速率v(O2)为8.33×10-3mol•L-1•s-1,反应的平衡常数K1为0.36.
(3)300℃时达平衡后,改变反应温度为T,并加入催化剂,c(O2)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡,列式计算温度T时反应的平衡常数K2为0.845.
(4)某小组对碳酸锰的分解条件(温度、湿度)进行研究,得到如下三组图象(图2),则合适的熔烧温度为350℃.

分析 (1)已知:①MnCO3(s)?MnO(s)+CO2(g)△H1;
②MnO(s)+O2(g)?2MnO2(s)△H2,
根据盖斯定律,①×2+②可得:2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g),反应热也进行相应的计算;
当△G=△H-T△S<0时,反应自发进行;
(2)由图可知,60s时到达平衡,二氧化碳的起始浓度为0.2mol/L,平衡时浓度为0.12mol/L,根据v=$\frac{△c}{△t}$计算v(CO2),再根据速率之比等于化学计量数之比计算v(O2),平衡时氧气浓度为0.04mol/L,代入平衡常数K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$计算;
(3)c(O2)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡,重新达到新平衡时氧气的浓度为0.04mol/L-0.0020mol•L-1•s-1×10s=0.02mol/L,则平衡时v(CO2)=0.12mol/L+0.02mol/L×$\frac{1}{2}$=0.13mol/L,代入平衡常数K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$计算;
(4)应选择碳酸锰转化率最高时的温度.
解答 解:(1)已知:①MnCO3(s)?MnO(s)+CO2(g)△H1;
②MnO(s)+O2(g)?2MnO2(s)△H2,
根据盖斯定律,①×2+②可得:2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g),则△H=2△H1+△H2;
反应②在低温下能自发进行,当△G=△H-T△S<0时,反应自发进行,只有△H<0,
故答案为:△H=2△H1+△H2;<;
(2)由图可知,60s时到达平衡,二氧化碳的起始浓度为0.2mol/L,平衡时浓度为0.12mol/L,则v(CO2)=$\frac{(0.12-0.02)mol/L}{60s}$=$\frac{1}{600}$mol/(L.s),再速率之比等于化学计量数之比,则v(O2)=$\frac{1}{2}$v(CO2)=8.33×10-3mol/(L.s),平衡时氧气浓度为0.04mol/L,则平衡常数K1=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$=$\frac{0.1{2}^{2}}{0.04}$=0.36,
故答案为:8.33×10-3mol/(L.s);0.36;
(3)c(O2)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡,重新达到新平衡时氧气的浓度为0.04mol/L-0.0020mol•L-1•s-1×10s=0.02mol/L,则平衡时v(CO2)=0.12mol/L+0.02mol/L×$\frac{1}{2}$=0.13mol/L,则平衡常数K2=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$=$\frac{0.1{3}^{2}}{0.02}$=0.845,
故答案为:0.845;
(4)由图2分析,在350℃左右碳酸锰转化率比较高,故答案为:350℃.
点评 本题考查反应热计算、反应速率计算、化学平衡常数、图象分析等,题目综合性强,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示:| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(l)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2和K3之间的关系,则K3=K1•K2(用K1、K2表示);根据反应③判断△S<(填“>”、“=”或“<”) 0,在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0,.1mol•L-1、0.8mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正>(填“>”、“=”或“<”) v逆.
(4)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温时,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
| A. |  稀释浓硫酸 | B. |  红色喷泉 | C. |  检验乙烯 | D. |  观察钾离子焰色 观察钾离子焰色 |
| 元素 | X | Y | Z | W |
| 原子半径/pm | 186 | 143 | 75 | 71 |
| 主要化合价 | +1 | +3 | +5、+3、-3 | -1 |
| A. | X、Y元素的金属性X<Y | |
| B. | Z的气态氢化物比W的气态氢化物稳定 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 四种元素对应的简单离子的离子半径大小顺序为Z3->W->X+>Y3+ |
| A. | 基态原子的4S能级中只有1个电子的元素共有4种 | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力不相同 | |
| C. | Cl-、S2-、Na+、K+半径逐渐减小 | |
| D. | 最外层有3个未成对电子的原子一定属于主族元素 |
| A. | Na2CO3、BaCl2、HCl | B. | BaCl2、Na2CO3、HCl | ||
| C. | BaCl2、Na2CO3、HNO3 | D. | BaCl2、K2CO3、HNO3 |
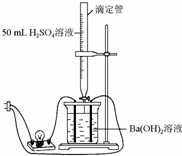 为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下: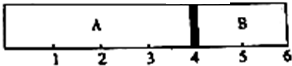 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.