题目内容
15.工业上从铝土矿(主要成分是Al2O3,还含有SiO2、Fe2O3等杂质)中提取铝可采用如图工艺流程(反应条件已经省略):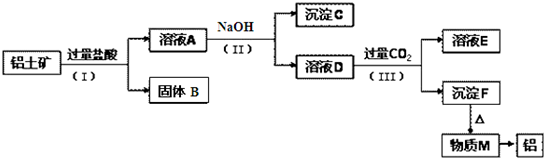
请回答下列问题:
(1)图中(Ⅰ)、(Ⅱ)、(Ⅲ)步骤中涉及分离溶液与沉淀的实验方法是过滤(填操作名称).
(2)Al2O3是两性氧化物,SiO2是酸性氧化物,Fe2O3是碱性氧化物,根据它们的性质,判断固体B的成分是SiO2(填化学式).
(3)Fe2O3和盐酸反应的化学方程式是Fe2O3+6HCl=2FeCl3+3H2O,沉淀C的化学式是Fe(OH)3.
(4)如果溶液D中通入“过量CO2”,改成通入“过量HCl”可以吗?为什么?不可以,因为产生Al(OH)3和过量盐酸反应.
(5)请写出上述流程中涉及的氧化还原反应的化学方程式:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
分析 铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、FeCl3和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Fe(OH)3,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al,据此答题.
解答 解:铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、FeCl3和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Fe(OH)3,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al,
(1)分离溶液与沉淀,常用过滤的方法,
故答案为:过滤;
(2)由以上分析可知沉淀B的成分是SiO2,
故答案为:SiO2;
(3)Fe2O3和盐酸反应的化学方程式是Fe2O3+6HCl=2FeCl3+3H2O,由以上分析可知沉淀C为Fe(OH)3,
故答案为:Fe2O3+6HCl=2FeCl3+3H2O;Fe(OH)3;
(4)将向溶液D中通入过量CO2换成加入过量盐酸,过量盐酸会和生成的氢氧化铝发生Al(OH)3+3HCl═AlCl3+3H2O,氢氧化铝溶解,所以不能,
故答案为:不可以;因为产生Al(OH)3和过量盐酸反应;
(5)上述流程中涉及的氧化还原反应为电解氧化铝制铝,反应的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅清楚提取的操作过程原理,而且需熟知物质间的反应,能熟练对知识迁移进行综合运用是解答的关键,题目难度中等.

| 酸 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 盐酸 | 纯碱 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 硫酸 | 烧碱 | 食盐 | 氧化钙 | 一氧化碳 |
| C | 醋酸 | 苛性碱 | 小苏打 | 一氧化碳 | 二氧化硫 |
| D | 硫酸 | 苛性钾 | 苏打 | 氧化铜 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 钚电池是将核能转化为电能 | |
| B. | 放射源一端为正极,集电器一端为负极 | |
| C. | 核源料是可再生能源 | |
| D. | ${\;}_{94}^{238}$Pu的原子质量是12 C原子质量的238倍 |
| A. | 苯 | B. | 甲苯 | C. | 苯甲醇 | D. | 苯酚 |
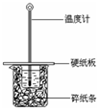 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.

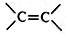 );下列试剂能与甲反应而褪色的是ac(填标号)
);下列试剂能与甲反应而褪色的是ac(填标号) +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$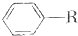 +HCl(-R为烃基)
+HCl(-R为烃基)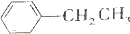 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$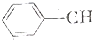 =CH2+H2
=CH2+H2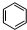 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$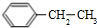 +HCl
+HCl .
.