题目内容
【题目】M、N、R、X、Y为原子序数依次增大的短周期主族元素,Z、W都是第四周期过渡元素。R是同主族元素中最活泼的非金属元素,且能生成MR2型共价化合物, Z和Z2+具有相同的单电子数,Z2+的价电子数是W+的二分之一, W 有W +和W2+两种常见离子,R和X同主族。请回答下列问题(以下均用化学符号表示):
(1)写出R基态原子的电子排布图_________________,M、N和R第一电离能由小到大的顺序是____________。
(2)N的气态氢化物极易溶于R的氢化物,且该体系呈碱性,请用结构式表示出两者主要的结合方式_________________。
(3)在上述元素形成的分子中,有四种分子互为等电子体,分别是MR2、MX2和MRX以及_______,该分子的结构式为___________,N与Y形成的NY3分子的空间构型是________。
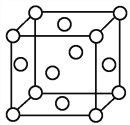
(4)M和R所形成MR2晶体以及W晶体的结构都可以如图表示(O表示一个MR2分子或一个W原子),晶体中正八面体和正四面体空隙数的比值是_________,Z的硫化物有3种晶体,其中一种是Z2+为面心立方堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两种离子核间距为acm,则该晶体密度为__________________。
(5)Z的一种氧化物常用来氧化Y的氢化物的水化物的浓溶液制备Y2,该反应的化学方程式是____________。
【答案】 ![]() C<O<N
C<O<N 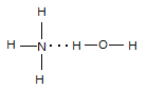 N2O N=N=O 三角锥型 1:2 261
N2O N=N=O 三角锥型 1:2 261![]() /16NAa3 MnO2+4HCl(浓)
/16NAa3 MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
【解析】M、N、R、X、Y为原子序数依次增大的短周期主族元素, R是同主族元素中最活泼的非金属元素,且能生成MR2型共价化合物,则M为+4价,R为-2价,R和X同主族,因此R为O,M为C;X为S,则Y为Cl,N为N元素;Z、W都是第四周期过渡元素,W 有W +和W2+两种常见离子,则W为Cu元素;Z和Z2+具有相同的单电子数,Z2+的价电子数是W+的二分之一,则Z2+的价电子排布式为3d5,Z为Mn元素。
(1)R为O元素,基态O原子的电子排布图为![]() ;同周期的主族元素随核电荷数的增大,第一电离能呈增大的趋势,但氮的2p轨道为半充满结构,相对稳定,则C、N、O的第一电离能由小到大的顺序是C<O<N,故答案为:
;同周期的主族元素随核电荷数的增大,第一电离能呈增大的趋势,但氮的2p轨道为半充满结构,相对稳定,则C、N、O的第一电离能由小到大的顺序是C<O<N,故答案为:![]() ;C<O<N;
;C<O<N;
(2)NH3与H2O均为极性分子,且NH3与H2O分子之间存在氢键,根据相似相溶原理,故NH3易溶于水,氨水中存在NH3H2O,能部分电离出OH-,导致氨水显碱性,NH3H2O的结构式为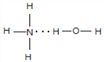 ,故答案为:
,故答案为: 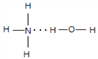 ;
;
(3)在上述元素形成的分子中,有四种分子互为等电子体,分别是CO2、CS2和COS以及N2O,等电子体检验相似的结构,则N2O的结构式为N=N=O,NCl3中N原子含有3个σ键和1个孤电子对,中心原子N是sp3杂化,则NCl3为三角锥型,故答案为:N2O;N=N=O;三角锥型;
(4)由晶胞结构可知,一个晶胞围成正八面体空隙共有4个(如图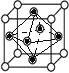 1个和12个
1个和12个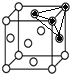 ,是正八面体的
,是正八面体的![]() ,计3个);晶体中共有类似A点的顶点共有8个,晶体中围成正四面体空隙共有8个(如图
,计3个);晶体中共有类似A点的顶点共有8个,晶体中围成正四面体空隙共有8个(如图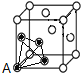 ),个数比为4:8=1:2;MnS有3种晶体,其中一种是Mn2+为面心立方堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,则晶胞结构为
),个数比为4:8=1:2;MnS有3种晶体,其中一种是Mn2+为面心立方堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,则晶胞结构为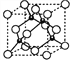 ,在晶胞中Mn2+共有8×
,在晶胞中Mn2+共有8×![]() +6×
+6×![]() =4,S2-共有4个,设晶胞的边长为x,则
=4,S2-共有4个,设晶胞的边长为x,则![]() x=4acm,x=
x=4acm,x=![]() cm,因此晶体密度=
cm,因此晶体密度=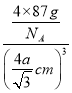 =
=![]() g/cm3,故答案为:1:2;
g/cm3,故答案为:1:2; ![]() ;
;
(5)二氧化锰常用来氧化氯化氢的水化物的浓溶液制备氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O。
MnCl2+Cl2+2H2O。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
