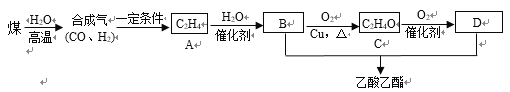
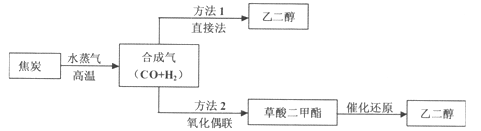
题目内容
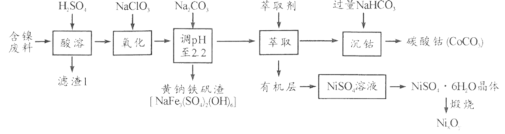
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
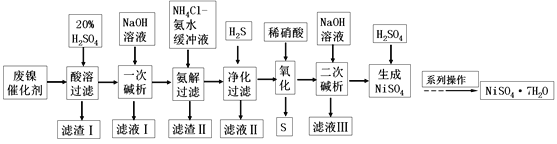
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有________(任写出一条)。
(2)“滤渣I”的主要成分是_________。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为__________。
(4)“氨解”的目的为___,“净化”时加入的H2S的目的是将镍元素转化为____沉淀。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_______(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
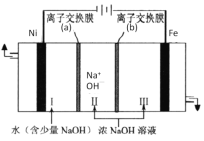
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为________,离子交换膜(b)为__________(填“阴”或“阳”)离子交换膜。
【答案】升高温度、将废镍催化剂粉碎、搅拌等 SiO2 Cr3++4OH-=CrO2-+2H2O 除去Fe3+ NiS 3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O 1.4×10-5mol/L Fe-6e-+8OH-=FeO42-+4H2O 阴
【解析】
废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍,加入20%的硫酸酸溶,NiCO3、Fe2O3、Cr2O3反应进入溶液中,SiO2不能反应,过滤,滤渣Ⅰ为SiO2,滤液加入NaOH溶液进行一次碱析,滤液Ⅰ含有CrO2-,沉淀加入氯化铵、氨水缓冲液,由信息②可知滤渣Ⅱ为Fe(OH)3,过滤得到的滤液含有[Ni(NH3)6]2+,“净化”时通入的H2S,可以将镍元素转化为NiS沉淀,加入硝酸氧化,可生成S和Ni2+,加入氢氧化钠生成Ni(OH)2,过滤后加入硫酸可得到硫酸镍,经蒸发浓缩、冷却结晶得到硫酸镍晶体,以此解答该题。
(1)“酸溶”时为了提高浸取率,可以先将废镍催化剂粉碎,以增大固体表面积,或进行搅拌,并在加热条件下使废镍催化剂与20%硫酸充分反应等;
(2)“滤渣Ⅰ”主要成分为二氧化硅;
(3)Cr(OH)3难溶于水,Cr(OH)3是两性氢氧化物,可以与过量的NaOH溶液发生反应产生CrO2-,则含铬微粒发生反应的离子方程式为Cr3++4OH-=CrO2-+2H2O;
(4)加入氯化铵和氨水的缓冲液,可生成Fe(OH)3沉淀,同时生成[Ni(NH3)6]2+,达到除去Fe3+的目的;“净化”时通入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为[Ni[Ni(NH3)6]2++H2S=NiS↓+2NH4++4NH3↑;
(5)“氧化”时HNO3将NiS氧化为S单质,HNO3被还原为NO,发生反应的离子方程式为3NiS+8H++2NO3-=3Ni2++2NO↑+3S↓+4H2O,从而可除去硫,生成镍离子;
(6)离子浓度≤1×10-5mol/L时,离子沉淀完全,已知Ni(OH)2的Ksp=2×10-15,则c(OH-)=![]() mol/L=1.4×10-5mol/L;
mol/L=1.4×10-5mol/L;
(7)电解池中阳极发生氧化反应,依据题意可知铁在阳极失去电子,碱性环境下生成高铁酸根离子FeO42-,阳极的电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,离子交换膜(b)为阴离子交换膜,可使氢氧根离子进入阳极区。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案