题目内容
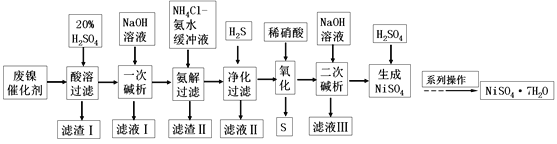
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:
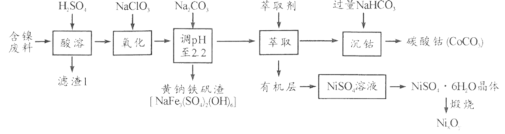
(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
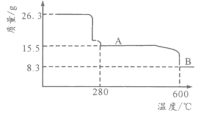
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。
【答案】提高浸出率或提高浸出速率(或其他合理答案) SiO2 Fe2+氧化为Fe3+ K3[Fe(CN)6] 3Fe3++Na++2SO42-+3H2O+3CO32-=NaFe3(SO4)3(OH)6↓+3CO2↑ Co2++2HCO3-=CoCO3↓+CO2↑+H2O 7.3 降温结晶(或冷却结晶) Ni2O3
【解析】
金属镍废料(除含 NiO 外,还含有少量 FeO、Fe2O3、CoO等)加入硫酸酸浸,酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Co2+等,加入NaClO3氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得黄钠铁矾渣,滤液中加入萃取剂得到沉钴和有机层,沉钴中加入NaHCO3溶液得碳酸钴;有机层处理后生成NiSO4溶液,蒸发浓缩、冷却结晶、得NiSO4·6H2O晶体,灼烧得NixOy
(1)“酸溶”时需将含镍废料粉碎,目的是提高浸出率或提高浸出速率(或其他合理答案);
“滤渣Ⅰ”主要成分为SiO2(填化学式)。
(2)"氧化"中添加NaClO3的作用是将Fe2+氧化为Fe3+便于除去,为证明添加NaClO3已足量,实际是检验是否含有Fe2+,可用K3[Fe(CN)6]溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为3Fe3++Na++2SO42-+3H2O+3CO32-=NaFe3(SO4)3(OH)6↓+3CO2↑。
(4)“沉钴”过程的离子方程式Co2++2HCO3-=CoCO3↓+CO2↑+H2O。
若“沉钴”开始时c(Co2+)=0.10 mol/L,Ksp[Co(OH)2]=4.0×10-15=c(Co2+)c2(OH-)=0.10×c2(OH-),c(OH-)=2×10-7,c(H+)=![]() ,pH=-lg
,pH=-lg![]() =7+lg2=7.3,则控制pH≤7.3时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3);
=7+lg2=7.3,则控制pH≤7.3时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3);
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,降温结晶(或冷却结晶),过滤,洗涤,干燥。
“煅烧”时剩余固体质量与温度变化曲线如图,从26.3gNiSO4·6H2O失水变成15.5g,n(NiSO4·6H2O):n(H2O)=![]() ,26.3gNiSO4·6H2O中n(Ni)=
,26.3gNiSO4·6H2O中n(Ni)=![]() =0.10mol,8.3g中n(Ni):n(O)=0.1mol:
=0.10mol,8.3g中n(Ni):n(O)=0.1mol:![]() =2:3,该曲线中B段所表示氧化物的化学式为Ni2O3。
=2:3,该曲线中B段所表示氧化物的化学式为Ni2O3。

【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识正确的是![]()
选项 | 古诗文 | 化学知识 |
A |
| 冰能量低于水,冰变为水属于吸热反应 |
B |
| “强水”是指氢氟酸 |
C |
| 剂钢为铁的合金,其硬度比纯铁的大,熔点比纯铁的高 |
D |
| 鉴别硝石和朴硝利用了焰色反应 |
A.AB.BC.CD.D
【题目】某研究性学习小组设计实验探究元素周期律和化学反应速率。
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。
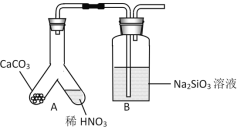
①A中反应现象为____,验证碳的非金属性比氮的___(填“强”或“弱”)。
②B中反应现象为____,验证碳的非金属性比硅的___(填“强”或“弱”)。
③结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”); 同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有_______试剂的洗气瓶。
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
实验序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
①实验1中,在10~20 min内,v(HI)=__________molL-1min-l。
②0~20 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是_______________。
③实验3比实验2的反应达到平衡时间_________(填“长”或“短”),其原因是_________________________________________。