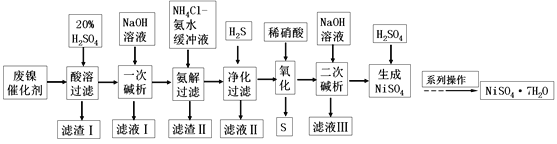
题目内容
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:
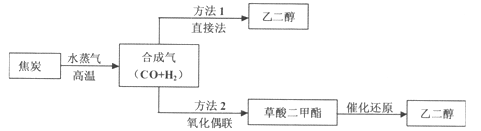
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
【答案】2CO+3H2![]() HOCH2CH2OH B CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3kJ/mol BC ①HC2O4-
HOCH2CH2OH B CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3kJ/mol BC ①HC2O4-![]() H++ C2O42-, HC2O4-+H2O
H++ C2O42-, HC2O4-+H2O![]() H2C2O4+OH-,草酸氢根离子的电离程度大于其水解程度 AC 负 HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O
H2C2O4+OH-,草酸氢根离子的电离程度大于其水解程度 AC 负 HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O
【解析】
(1)CO与氢气在催化剂条件下生成乙二醇,化学方程式为2CO+3H2![]() HOCH2CH2OH;
HOCH2CH2OH;
(2)根据元素守恒定律,仅用CO和氢气为原料,无法合成草酸和尿素,只能合成甲醇,且原料气全部转化为甲醇,原子的利用率100%,答案选B;
(3)根据盖斯定律,将第一个热化学方程式减去第二和第三个热化学方程式的和可得所求的热化学方程式,所以甲烷与二氧化碳反应制取CO和氢气的热化学方程式是CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3)kJ/mol-(-571.6-566.0)kJ/mol=+247.3kJ/mol;
(4)A.升高温度,则平衡逆向移动,反应速率加快,但产率降低,错误; B.增大压强,平衡正向移动,乙二醇的产率增大,反应速率加快,正确;C.增大氢气浓度,则平衡正向移动,乙二醇的产率增大,反应物浓度增大,反应速率加快,正确,答案选BC;
(5)①草酸是二元弱酸,草酸氢钾溶液呈酸性,溶液中存在HC2O4-![]() H++ C2O42-, HC2O4-+H2O
H++ C2O42-, HC2O4-+H2O![]() H2C2O4+OH-,因为草酸氢根离子的电离程度大于其水解程度,所以溶液呈酸性;
H2C2O4+OH-,因为草酸氢根离子的电离程度大于其水解程度,所以溶液呈酸性;
②A、若钠离子浓度大于钾离子浓度,则氢氧化钠的物质的量大于草酸氢钾的物质的量,则溶液呈碱性,错误;B、根据草酸氢钾的化学式,则符合物料守恒,正确;C、中性溶液中c(OH-)= c(H+),结合电荷守恒定律,则c(Na+)+ c(K+)= c(HC2O4-)+ 2c(C2O42-),错误,答案选AC;
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极发生氧化反应,所以作电源的负极;乙二醇失去电子,与氢氧根离子结合为碳酸根离子和水,电极反应式为HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O。

【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
选项 | 方法 | 现象 | 结论 |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A.AB.BC.CD.D