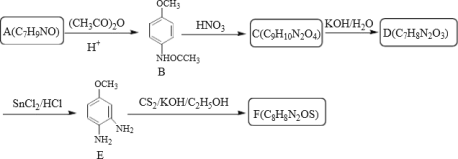
题目内容
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂被誉为“高能金属”,是锂离子电池的电极材料。工业上常用β锂辉矿(主要成分为Li2O·Al2O3·4SiO2以及少量钙、镁杂质)和氟磷灰石(Ca5P3FO12)为原料制取锂离子电池正极材料LiFePO4,工艺流程如图:
已知:①残留在溶液中的离子浓度小于10-5 mol·L-1 说明该离子沉淀完全;
②常温下,Ksp[Al(OH)3]=2.7×10-34、Ksp[Mg(OH)2]= 1.2×10-1 ;
③LiFePO4难溶于水。
回答下列问题:
(1)氟磷灰石(Ca5P3FO12 )中磷元素的化合价为______ , 滤渣2的主要成分是______(写化学式)。
(2)操作I所需的玻璃仪器名称有烧杯____________,操作 3的名称是_____________。
(3)蒸发浓缩Li2SO4溶液的目的是_____________________。
(4)写出合成反应的离子方程式:____________________________________。
(5)一种锂离子电池的反应原理为LiFePO4![]() Li+FePO4。写出放电时正极电极反应式:_____________________________。
Li+FePO4。写出放电时正极电极反应式:_____________________________。
(6)若某企业制备110.6 t纯净的LiFePO4,需要300t含氧化锂5%的β锂辉矿石,则锂元素的利用率为__________________。
【答案】+5; Mg(OH)2,CaCO3 漏斗、玻璃棒 分液 增大溶液中Li+浓度,便于生成LiFePO4 Li++Fe2++H2PO4-= LiFePO4↓+2H+ FePO4+ Li++e-=LiFePO4 70%
【解析】
根据Ksp[Al(OH)3]=2.7×10-34,残留在溶液中的离子浓度小于10-5 mol·L-1,说明该离子沉淀完全,可计算铝离子完全沉淀的pH;计算过程如下:2.7×10-34=10-5 mol·L-1×![]() ,解得c(OH-)=3×10-10 mol·L-1,c(H+)=
,解得c(OH-)=3×10-10 mol·L-1,c(H+)=![]() =10-4.7,pH=4.7;同理Mg2+完全沉淀的pH=11.1,故第一步调pH=6后,Al3+已经形成沉淀,Mg2+未形成沉淀,所以滤渣1为SiO2和Al(OH)3,滤渣2为Mg(OH)2,CaCO3;Li2SO4溶液中还有一定的杂质Na+,据此解答。
=10-4.7,pH=4.7;同理Mg2+完全沉淀的pH=11.1,故第一步调pH=6后,Al3+已经形成沉淀,Mg2+未形成沉淀,所以滤渣1为SiO2和Al(OH)3,滤渣2为Mg(OH)2,CaCO3;Li2SO4溶液中还有一定的杂质Na+,据此解答。
(1)化合物中,化合价代数和为0,设P的化合价为x,则有(+2)×5+x×3+(-1)×1+(-2)×12=0,解得x=+5;由上面的分析可知,滤渣2主要还有Mg(OH)2,CaCO3,故答案为:+5;Mg(OH)2,CaCO3;
(2)操作1为过滤,所需的玻璃仪器名称有烧杯、漏斗、玻璃棒;操作2为萃取,操作3得到水相和有机相,因此为分液,故答案为:漏斗、玻璃棒;分液;
(3)蒸发浓缩Li2SO4,增大了溶液中Li+浓度,便于生成LiFePO4,故答案为:增大溶液中Li+浓度,便于生成LiFePO4;
(4)从合成前后的物质元素分析来看,所有元素化合价都未变化,为简单的离子反应,离子方程式为:Li++Fe2++H2PO4-=LiFePO4↓+2H+,故答案为:Li++Fe2++H2PO4-=LiFePO4↓+2H+;
(5)放电时工作原理为原电池原理,正极得电子,化合价降低,被还原,电极反应式为:FePO4+ Li ++e-=LiFePO4,故答案为:FePO4+ Li ++e-=LiFePO4;
(6)300t含氧化锂5%的锂辉矿石中Li2O的质量=300t×5%=15t,根据锂原子守恒Li2O和LiFePO4的关系式为Li2O~2LiFePO4计算如下![]() ,实际得到110.6t,则利用率=
,实际得到110.6t,则利用率=![]() ×100%=70%,故答案为:70%。
×100%=70%,故答案为:70%。

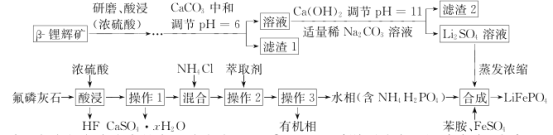
【题目】固氮作用有3种途径:生物固氮、人工固氮和大气固氮。如表列举了不同温度下大气固氮的部分平衡常数K值。![]() 时,向
时,向![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,10s时反应达到平衡。
,10s时反应达到平衡。
反应 | 大气固氮 | |
温度/℃ | 27 | 2260 |
K |
| 1 |
下列说法正确的是( )
A.大气固氮反应属于放热反应
B.10 s末,![]() 的转化率约为
的转化率约为![]()
C.10 s内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
D.10 s末,再向容器中充入![]() mol
mol ![]() 和
和![]() mol
mol ![]() ,
,![]() 的平衡转化率不变
的平衡转化率不变
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是__。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
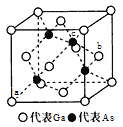
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为____。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,![]() ,
,![]() ),则c原子的坐标参数为_____。
),则c原子的坐标参数为_____。